Jumlah Pelat Total (TPC):
Untuk menghitung bakteri yang ada dalam sampel dengan metode pelapisan agar pengenceran serial atau metode jumlah lempeng total (TPC).
Tujuan:
Tingkat aktivitas bakteri dalam sampel tertentu dalam serangkaian kondisi tertentu terutama bergantung pada jumlah total bakteri yang ada di dalamnya terlepas dari spesiesnya.
Oleh karena itu, sangat sering diperlukan untuk mengetahui jumlah total bakteri yang ada dalam sampel makanan, air, tanah, udara, dan jaringan selama analisis mikrobiologisnya. Jumlah total bakteri ini termasuk bakteri hidup dan mati.’ Bakteri mati tidak dapat tumbuh dan bereproduksi.
Hanya bakteri hidup (bakteri hidup), yang dapat tumbuh dan berkembang biak menghasilkan aktivitas bakteri tertentu. Oleh karena itu, sangat sering diperlukan untuk menghitung sel bakteri yang hidup dalam sampel yang berbeda. Namun, sebagian besar metode pencacahan seperti penghitungan mikroskopis langsung, penghitungan sel elektronik, metode kimia dan metode spektrofotometri menghitung sel hidup dan sel mati.
Metode ini tidak dapat membedakan antara sel hidup dan sel mati. Oleh karena itu, metode serial pengenceran-agar pelapisan, yang menghitung hanya sel bakteri yang hidup, adalah metode yang digunakan secara universal untuk menghitung sel hidup yang hidup dalam sampel yang berbeda.
Prinsip:
Sampel padat dengan berat tertentu dihomogenkan secara aseptis dalam sembilan volume larutan garam steril untuk mendapatkan suspensi bakteri yang homogen. Sampel cair langsung digunakan sebagai suspensi homogen bakteri. Suspensi bakteri yang diperoleh diencerkan secara berurutan (10 kali, 100 kali, 1000 kali, dll.). Di sini 10 -1 , 10 -2 , 10 -3 dst disebut pengenceran.
Kebalikannya (10 1 , 10 2 , 10 3 dst.) disebut faktor pengenceran. Volume tertentu dari suspensi bakteri dari setiap pengenceran diinokulasikan ke cawan agar dan disebarkan dengan baik, untuk memisahkan sel-sel bakteri secara terpisah dan mengisolasinya satu sama lain.
Inokulasi bakteri untuk pencacahannya dilakukan dengan dua teknik sebagai berikut:
- Teknik piring tuang
- Teknik sebar piring
- Teknik Tuang Piring:
Dalam teknik ini, 1 ml suspensi bakteri diteteskan ke cawan petri yang telah disterilkan dan media agar nutrisi cair dituangkan di atasnya. Cawan petri diaduk perlahan, agar suspensi dapat bercampur dengan media secara merata. Itu dibiarkan dingin dan mengeras.
- Teknik Spread Plate:
Dalam teknik ini 0,1 ml suspensi bakteri diteteskan ke piring agar yang telah disiapkan. Kemudian, tetesan suspensi disebarkan secara merata pada pelat agar dengan penyebar kaca yang telah disterilkan.
Untuk meminimalkan kesalahan, setiap suspensi yang diencerkan dilapiskan ke 2-5 pelat ulangan. Pelat yang diinokulasi diinkubasi pada suhu 37°C selama 24 jam. Selama periode ini, setiap sel bakteri individu yang diisolasi pada lempeng agar tumbuh dan berkembang biak dengan cepat untuk menghasilkan massa sel bakteri yang terlihat secara makroskopik yang disebut ‘koloni’. Dengan demikian, jumlah koloni pada cawan mewakili jumlah bakteri dalam sampel.
Namun, sangat sering, selama penyebaran, beberapa sel mungkin tidak dapat dipisahkan dengan benar dan beberapa sel yang tidak terpisah tersebut dapat menimbulkan satu koloni. Selain itu, beberapa sel memiliki kecenderungan untuk tetap berpasangan, berantai, atau berkelompok.
Di sini, setiap pasangan, rantai, atau kluster menghasilkan koloni. Jadi, setiap koloni, dalam arti sempit, tidak mewakili satu bakteri pun. Itu sebabnya, alih-alih menyatakan jumlah bakteri sebagai ‘No. bakteri/gm atau ml sampel’, sering dinyatakan sebagai jumlah unit pembentuk koloni per gm atau ml (CFU/gm atau ml).
Total plate count (TPC) dalam sampel asli dihitung dengan mengalikan jumlah CPU dengan masing-masing faktor pengenceran. ‘Aturan pencacahan’ diikuti, sambil menghitung jumlah bakteri dalam sampel asli.
Bahan yang Dibutuhkan:
Cawan petri (15 no.), pipet 2 ml (10 no.), pipet 10 ml (1 no.), tabung reaksi (10 no.), labu berbentuk kerucut (masing-masing 500 ml dan 1 liter-1 no.) , gelas kimia 500 ml (2 nos.), penyebar kaca, wadah pipet baja tahan karat, kertas kerajinan, benang (atau karet gelang), kapas non-penyerap, etil alkohol, natrium klorida (NaCl), asam klorida 0,1N (HCI), Natrium hidroksida (NaOH) 0,1N, air suling, agar nutrisi, sampel cair (misalnya air kolam/air limbah), sampel padat (misalnya tanah/daging ikan/daging tiram/makanan olahan), kertas pH (atau pH meter), alu dan mortar (atau homogeniser), pembakar bunsen, oven udara panas, autoklaf, inkubator, ruang aliran laminar, penghitung koloni Quebec.
Prosedur:
- Sepuluh pipet (dalam kotak pipet stainless steel), 15 cawan petri dan sepasang alu dan mortar (atau satu cangkir homogeniser) disterilkan dalam oven udara panas pada suhu 180° C selama 3 jam. Alternatifnya, mereka dapat ditutup dengan kertas kerajinan, diikat dengan benang atau karet gelang dan disterilkan dalam autoklaf bersama dengan medianya (Gambar 6.6).
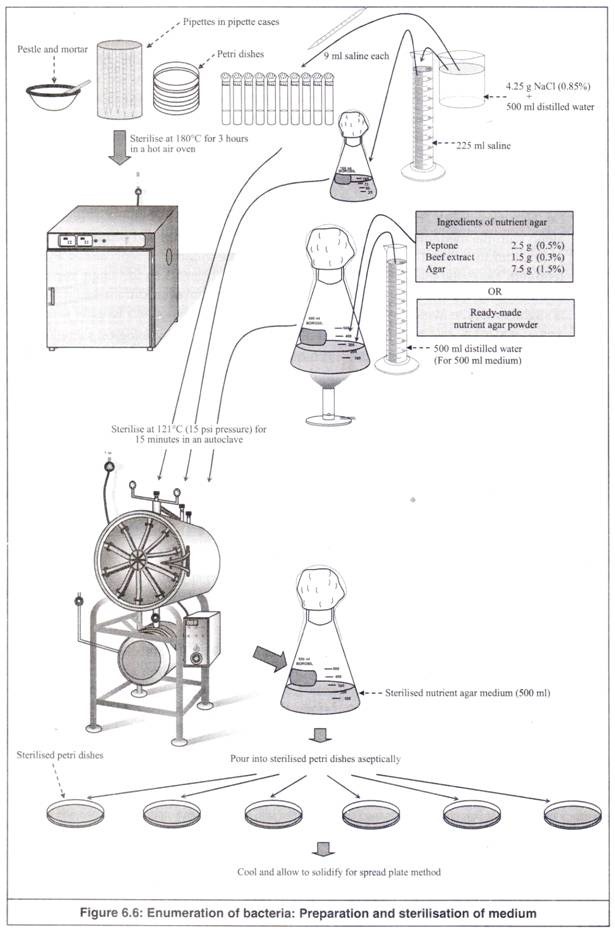
Jumlah cawan petri dan jumlah media yang akan digunakan dihitung tergantung pada jumlah ulangan dan pengenceran yang diperlukan. Di sini, gelas dan media diambil untuk replikasi tunggal dan pengenceran hingga 10 -6 . Jumlah alat gelas dan media yang digunakan untuk sterilisasi sedikit lebih banyak untuk menghindari kesalahan yang tidak disengaja, karena proses sterilisasi membutuhkan waktu yang lama.
- 4,25 g NaCl dilarutkan dalam 500 ml air suling untuk mendapatkan garam fisiologis (0,85%). 225 ml larutan garam ini dituangkan ke dalam labu berbentuk kerucut 500 ml. Mulutnya disumbat kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang. Ini digunakan sebagai pengencer pertama untuk mengencerkan sampel padat.
- 9,0 ml sisa garam juga dipipet ke masing-masing 10 tabung reaksi. Mulut mereka ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang. Ini digunakan sebagai pengencer untuk pengenceran serial.
- Bahan media nutrien agar atau bubuk siap pakainya sebanyak 500 ml media ditimbang dan dilarutkan dalam 500 ml air suling dalam labu berbentuk kerucut 1 liter dengan cara dikocok dan diaduk.
Ditentukan pH-nya menggunakan kertas pH atau pH meter dan diatur menjadi 7,0 menggunakan HC1 0,1N jika lebih banyak atau menggunakan NaOH 0,1N jika lebih sedikit. Labu dipanaskan untuk melarutkan agar-agar dalam media sepenuhnya. Kemudian ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Labu berbentuk kerucut 500 ml berisi 225 ml larutan garam, 10 tabung reaksi masing-masing berisi 9 ml larutan garam dan labu berbentuk kerucut 1 liter berisi 500 ml media agar nutrisi disterilkan pada suhu 121°C (tekanan 15 psi) selama 15 menit dalam autoklaf.
- Setelah sterilisasi, bahan yang telah disterilkan dikeluarkan dari autoklaf dan dibiarkan dingin beberapa saat, tanpa membiarkan media memadat. Pendinginan medium mencegah kondensasi dan akumulasi tetesan air di dalam pelat. Jika media telah disiapkan dan dipadatkan selama penyimpanan, maka harus dicairkan dengan cara dipanaskan secara hati-hati sampai benar-benar meleleh.
- Untuk menyiapkan cawan agar, sebelum media agar nutrisi yang telah disterilkan mendingin dan memadat, dalam kondisi cair yang hangat, dituangkan secara aseptis ke dalam 6 cawan petri yang telah disterilkan (masing-masing kurang lebih 20 ml), sehingga media cair menutupi bagian bawah cawan petri. hidangan sepenuhnya.
Kemudian, pelat ditutup dengan tutupnya dan dibiarkan dingin, untuk memadatkan media di dalamnya. Uap air yang mungkin mengembun pada permukaan bagian dalam pelat dan tutup diuapkan dengan menjaga pelat dan tutup dalam posisi terbalik di dalam inkubator pada suhu 37°C selama kurang lebih 1 jam.
- 25 g sampel padat (misalnya daging ikan/daging tiram/makanan olahan) ditimbang dan dihomogenkan dalam 225 ml saline steril (pengencer) secara aseptik (Gambar 6.7). Ini memberikan pengenceran 10 kali (pengenceran = 10 -1 ). Untuk sampel cair, 1 ml sampel dipipet secara aseptis ke dalam tabung salin steril 9 ml. Ini juga memberikan pengenceran 10 kali (pengenceran = 10 -1 ).
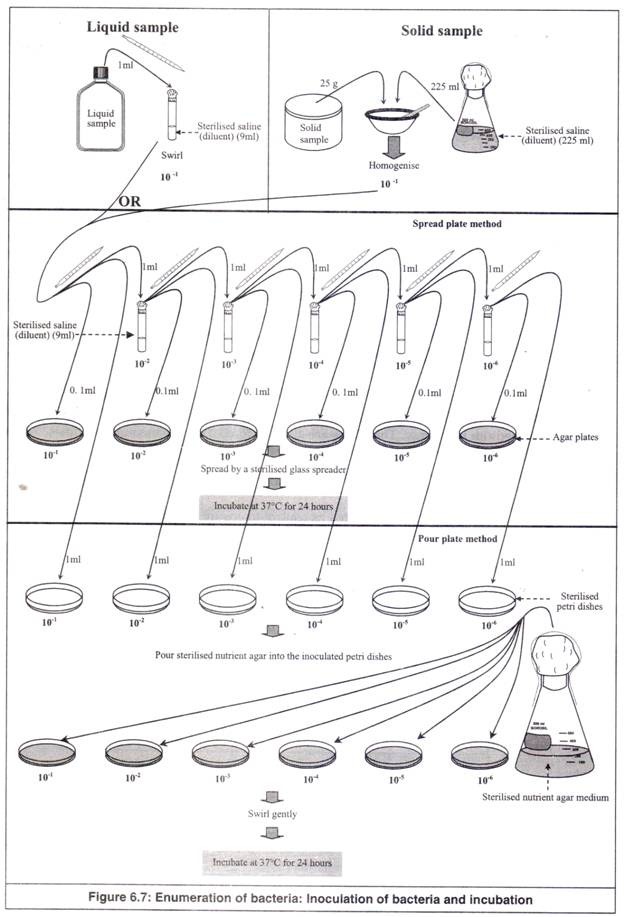
- 1 ml pengenceran 10 -1 dipindahkan ke 9 ml saline steril dalam tabung reaksi lain. Ini menghasilkan pengenceran 100 kali (pengenceran =10 -2 ). Dari pengenceran 10 -2 , 1 ml diteteskan ke cawan petri steril dan 0,1 ml ke cawan agar, dari pipet yang sama. Untuk setiap pengenceran, digunakan pipet steril yang terpisah. Setelah digunakan dicelupkan ke dalam toples pembuangan.
- 1 ml pengenceran 10 -2 dipindahkan ke 9 ml saline steril dalam tabung reaksi lain. Ini menghasilkan pengenceran 1000 kali (pengenceran =10 -3 ). Dari pengenceran 10 -3 , 1 ml diteteskan ke cawan petri steril dan 0,1 ml ke cawan agar, dari pipet yang sama. Dengan cara yang sama, pengenceran dilanjutkan hingga 10 -6 secara berurutan, setiap kali memindahkan 1 ml ke cawan petri steril dan 0,1 ml ke cawan agar dari pipet yang sama.
- Tetesan suspensi pada pelat agar kemudian ditebarkan secara aseptik dengan penyebar kaca yang telah disterilkan. Setelah menyebar di setiap piring, itu disterilkan dengan api dengan mencelupkannya ke dalam alkohol dan menunjukkannya di atas api. Ini adalah ‘teknik spread plate’.
- Cawan petri yang masing-masing berisi 1 ml suspensi bakteri diambil dan agar nutrisi cair yang telah disterilkan dituangkan ke dalamnya. Mereka diaduk dengan lembut, agar suspensi dapat bercampur dengan media secara merata. Pelat dibiarkan dingin sampai media mengeras. Ini adalah ‘teknik piring tuang’.
- Kemudian cawan diinkubasi dengan posisi terbalik, atas ke bawah, pada suhu 37°C selama 24 jam dalam inkubator (Gambar 6.7).
- Pelat agar yang tidak diinokulasi diinkubasi sebagai kontrol untuk memastikan sterilisasi yang tepat seperti yang ditunjukkan tidak ada pertumbuhan di atasnya.
Pengamatan:
Jumlah koloni bakteri di piring dihitung secara langsung atau dengan bantuan penghitung koloni Quebec. Dari sini, jumlah bakteri yang ada per gram atau ml sampel asli dihitung. Ini disebut pencacahan.

Aturan Pencacahan:
- Cawan petri dengan 30 hingga 300 koloni harus dipertimbangkan.
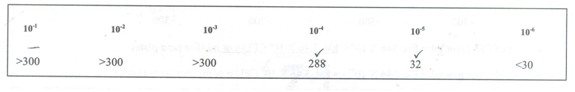
- Jumlah rata-rata duplikat dan rangkap tiga (R 1 , R 2 R 3 …) dianggap hanya jika satu hitungan tidak lebih dari dua kali hitungan lainnya. Jika satu lebih dari dua kali lipat dari nilai lain yang lebih rendah diambil.

- Untuk teknik cawan tuang, jumlah bakteri adalah No.X 10 c /gm, dimana c = faktor pengenceran. Untuk teknik spread plate, jumlah bakteri adalah No. X10 c+1 /gm, dimana c = faktor pengenceran. Angka tersebut diubah menjadi dua tempat desimal dalam bentuk (x.yz X 10 m ). Misalnya, 288 X 10 4 dinyatakan sebagai 2,88 X 10 6 .

- Jika pada semua pengenceran jumlah koloni lebih dari 300, dihitung pengenceran tertinggi dan jika pada semua pengenceran kurang dari 30, dihitung pengenceran terendah. Dalam kedua kasus hitungan direpresentasikan sebagai: Estimasi No. X 10 c /gm atau ml untuk teknik pour plate dan Estimasi No. X 10 c+1 /gm atau ml untuk teknik spread plate.

- Jika tidak ada koloni yang teramati pada setiap pengenceran yang diambil, hal ini direpresentasikan sebagai: Estimasi <1 x pengenceran terendah.

- Karena seri pengenceran dilakukan sebanyak 10 kali, secara matematis jelas bahwa tidak ada dua pengenceran yang dapat memiliki koloni antara 30 dan 300. Misalnya, jika 10 -3 memiliki 50 koloni, 10 -2 seharusnya memiliki 500 (yaitu > 300) dan 10 -4 harus memiliki 5 (yaitu <30) koloni.
Namun, ini tidak terjadi dalam kenyataan, karena bakteri tidak muncul sebagai larutan homogen; agak terjadi sebagai suspensi dalam pengencer. Jika ada dua pengenceran yang memiliki koloni yang dapat dihitung (antara 30 dan 300), hitung terlebih dahulu jumlah unit pembentuk koloni/gm atau ml menggunakan setiap pengenceran.
Jika satu nilai lebih dari dua kali lipat nilai lainnya, laporkan nilai yang lebih rendah. Jika tidak, ambil rata-rata dari kedua nilai tersebut dan laporkan nilai tersebut.




