Eksperimen untuk mengetahui kemampuan Bakteri untuk mendekarboksilasi asam amino yang berbeda!
Prinsip:
Beberapa bakteri memiliki kemampuan untuk mendekarboksilasi asam amino yang berbeda menjadi amina dan CO2 yang sesuai karena mereka dapat menghasilkan enzim ‘asam amino dekarboksilase’ masing-masing.
Di antara mereka, setiap bakteri hanya dapat mendekarboksilat beberapa asam amino, sementara yang lain tidak dapat mendekarboksilat.
Dengan demikian, asam amino yang dapat didekarboksilasi oleh bakteri dan asam amino yang tidak dapat didekarboksilasi adalah karakteristik bakteri. Tes dekarboksilase asam amino dilakukan untuk menguji, secara terpisah, kemampuan bakteri untuk mendekarboksilasi asam amino seperti lisin, ornitin dan argentina dengan produksi CO2 dan masing-masing amina seperti kadaverin, putresin dan agmatin.
Kalau bakteri bisa
dekarboksilat salah satu atau lebih asam amino, masing-masing amina diproduksi, yang bersifat basa (basa) dan oleh karena itu, meningkatkan pH mengubah warna ungu bromokresol dari kuning menjadi ungu.
Pada uji asam amino dekarboksilase, bakteri uji ditumbuhkan secara anaerob dalam media kaldu yang mengandung glukosa, bromokresol ungu dan salah satu asam amino. Warna kaldu mula-mula berubah dari ungu menjadi kuning akibat turunnya pH akibat asam hasil fermentasi glukosa. Jika bakteri memiliki kemampuan mendekarboksilasi asam amino, warna kaldu berubah dari kuning kembali menjadi ungu.
Bahan yang Dibutuhkan:
Tabung reaksi, labu berbentuk kerucut, sumbat kapas, loop inokulasi, autoklaf, pembakar bunsen, ruang aliran laminar, tabung pembuangan, inkubator, kaldu dekarboksilase asam amino, asam amino (lisin, ornitin, arginin), parafin cair, koloni terisolasi atau biakan murni dari bakteri.
Prosedur:
- Bahan media kaldu dekarboksilase asam amino (mengandung glukosa dan bromokresol ungu sebagai komponen utama) atau bubuk siap pakai yang dibutuhkan sebanyak 400 ml kaldu ditimbang dan dilarutkan dalam 400 ml air suling dalam labu berbentuk kerucut 500 ml dengan gemetar dan berputar-putar (Gambar 7.11).
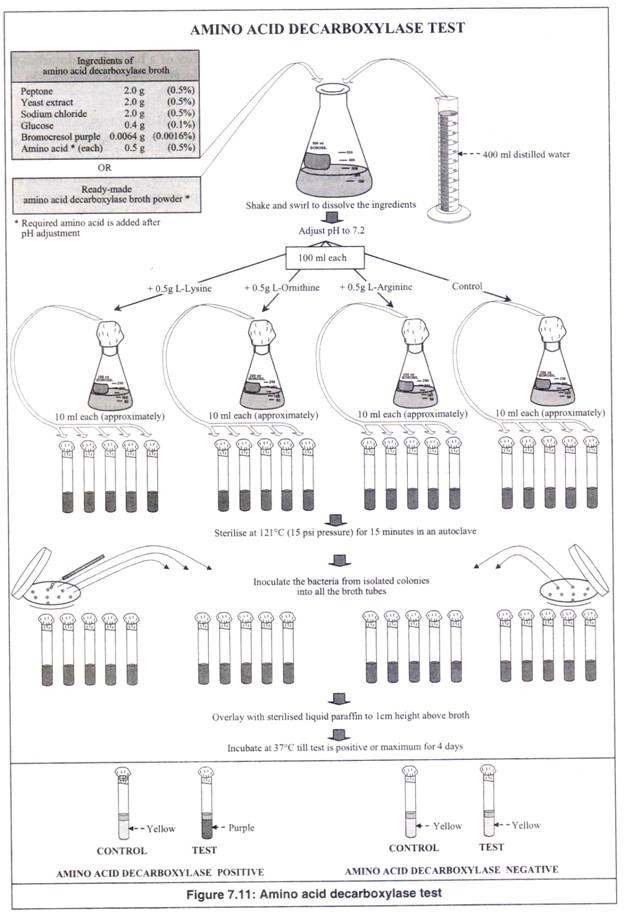
- Ditentukan pH-nya menggunakan kertas pH atau pH meter dan diatur menjadi 7,2 menggunakan HCI 0,1N jika lebih atau menggunakan NaOH 0,1N jika kurang. Labu dipanaskan, jika perlu, untuk melarutkan bahan sepenuhnya.
- Kaldu berukuran 400 ml tersebut didistribusikan ke dalam empat labu berukuran 250 ml, sehingga setiap labu berisi 100 ml kaldu.
- Ke tiga labu ini, tiga asam amino, seperti, lisin, ornitin dan arginin ditambahkan secara terpisah (masing-masing 0,5 gram) dan disimpan tanpa asam amino sebagai kontrol. Kontrol digunakan untuk membedakan antara dua tahap perubahan warna pada media uji (yaitu dari ungu menjadi kuning dan dari kuning kembali menjadi ungu).
- Kaldu dalam empat labu berbentuk kerucut didistribusikan ke dalam empat set tabung reaksi yang terpisah (masing-masing sekitar 10 ml), sumbat kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Tabung kaldu disterilkan pada suhu 121 °C (tekanan 15 psi) selama 15 menit dalam autoklaf.
- Tabung kaldu dibiarkan dingin hingga suhu kamar.
- Parafin cair disterilkan dengan cara dipanaskan pada suhu 180°C selama 3 jam dalam oven udara panas.
- Bakteri uji diinokulasi secara aseptis, sebaiknya dalam ruang aliran laminar, ke dalam kaldu dengan bantuan loop inokulasi yang disterilkan di atas api bunsen. Loop disterilkan setelah setiap inokulasi.
- Parafin cair yang telah disterilkan dituangkan perlahan secara aseptik ke dalam tabung yang telah diinokulasi, (setinggi media sekitar 1 cm) untuk memberikan kondisi anaerobik.
- Tabung kaldu yang telah diinokulasi diinkubasi pada suhu 37°C dalam inkubator dan diamati setiap hari sampai hasil tes positif atau selama maksimal 4 hari.
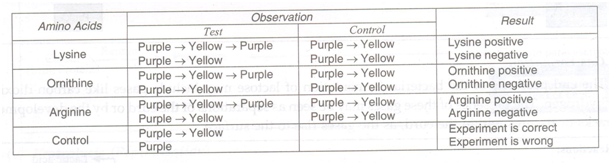
Pengamatan: