Baca artikel ini untuk mempelajari pengurangan beberapa polutan air limbah tertentu: 1. Arsenik 2. Kadmium 3. Kromium 4. Sianida 5. Fluorida 6. Logam Berat 7. Merkuri 8. Nutrisi 9. Fenol 10. Senyawa Organik yang Mudah Menguap dan 11 Pestisida.
Arsenik (As):
Sumber:
Senyawa arsenik dan arsenik sering terdapat dalam air limbah yang diproduksi di industri metalurgi, kaca, keramik, kilang minyak bumi, dan industri sejenis lainnya. Air limbah yang dihasilkan di unit manufaktur pewarna, pestisida, herbisida, dan beberapa bahan kimia anorganik dan organik lainnya mungkin juga mengandung senyawa arsenik. Senyawa arsenik juga telah ditemukan di air tanah di beberapa tempat.
Efek Beracun:
Senyawa arsenik cukup beracun. Ketika senyawa arsenik yang mengandung sekitar 100 mg AS tertelan, itu menyebabkan keracunan parah. Ketika As tertelan pada tingkat rendah, fraksi yang cukup besar terakumulasi dalam tubuh. Asupan berulang menyebabkan keracunan kronis, yang sulit didiagnosis pada tahap awal. Keracunan progresif menyebabkan penyakit “kaki hitam” dan selanjutnya menyebabkan kecacatan dan kematian. Batas maksimum arsenik dalam limbah industri yang diolah adalah 0,2 mg/L sebagai As, dan 0,01 mg/L dalam air minum.
Teknologi Perawatan:
Banyak informasi tersedia tentang metode untuk menghilangkan ion arsenit (ASO 2 – ) dan arsenat (ASO 3-4 ) dari air, tetapi relatif sedikit informasi yang tersedia tentang metode pengurangan jenis senyawa arsenik lainnya.
Metode pengolahan utama untuk menghilangkan arsenit dan arsenat dari air adalah:
(1) Pengendapan sebagai Sulfida,
(2) Kompleksasi dengan kation polivalen (Ca 2+ , Fe 3+ , Al 3+ ) dan pengendapan bersama dengan oksida logam,
(3) Adsorpsi pada karbon aktif atau alumina,
(4) Proses pertukaran ion, dan
(5) Proses pemisahan membran (RO).
Efisiensi penyisihan arsenit dengan metode pengendapan (sulfida atau kompleksasi) jauh lebih sedikit dibandingkan dengan arsenat. Untuk mencapai efisiensi penghilangan arsenat yang lebih tinggi, arsenat harus dioksidasi terlebih dahulu (melalui klorinasi) menjadi arsenat dan kemudian diendapkan. Penambahan natrium/Hidrogen Sulfida pada pH 6 sampai 7 mengendapkan arsenik sebagai sulfida.
Dari berbagai agen pengompleks yang digunakan, kapur telah ditemukan sebagai yang terbaik. Ferri (klorida/ sulfat) memiliki efisiensi yang lebih rendah daripada kapur. Alum memiliki efisiensi yang relatif buruk. PH optimal untuk kapur adalah 12, untuk garam besi 8,5-9 dan untuk tawas adalah 7-8. Pada pH yang lebih tinggi dari optimal efisiensi menurun tajam.
Kehadiran logam berat dalam air limbah meningkatkan efisiensi penyisihan arsenit dan arsenat. Selama sedimentasi dan filtrasi logam berat mengendap, beberapa arsenit dan arsenat teradsorpsi/terjerat ke dalam floes sehingga efisiensi penyisihan keseluruhan meningkat. Akhirnya, adsorpsi ke karbon aktif/alumina aktif menghilangkan beberapa senyawa arsenik sisa.
Perlu dicatat di sini bahwa efisiensi penyisihan karena adsorpsi ke alumina aktif granular lebih tinggi daripada karena kompleksasi tawas. Namun, alumina aktif jauh lebih mahal daripada tawas, yang pertama hanya dapat digunakan sebagai bahan pemoles. Proses pertukaran ion yang lebih mahal dapat digunakan untuk menghilangkan sisa arsenit/arsenat setelah menghilangkan sebagian besar dengan presipitasi/kompleks.
Proses pemisahan membran (RO) mampu menghilangkan senyawa arsenik anorganik dan organik. Tetapi karena biayanya yang lebih tinggi, metode ini hanya dapat digunakan jika metode yang telah dibahas sebelumnya tidak dapat mengurangi kandungan arsenik air limbah hingga tingkat yang diinginkan.
Kadmium (Cd):
Sumber:
Kadmium masuk ke dalam air limbah dari unit elektroplating, baterai primer, sel elektrokimia standar, peleburan seng, dan unit galvanisasi. Dalam bak galvanisasi kadmium dapat hadir sebagai kontaminan.
Efek Beracun:
Kadmium sangat beracun. Konsentrasinya dalam makanan sekitar 13-15 mg/L cenderung menyebabkan penyakit serius. Batas atas konsentrasinya dalam limbah yang diolah adalah 2 mg/L sebagai CD. Dalam air minum batasnya adalah 0,003 mg/L.
Teknologi Perawatan:
Kadmium dapat diendapkan dari air limbah sebagai hidroksida (Cd((OH)2) pada pH 10-11. Kadmium juga dapat diendapkan bersama dengan logam berat lainnya, seperti besi. Konsentrasi residunya dapat diturunkan menjadi sekitar 0,008 mg/L, bila diendapkan sebagai Sulfida (CdS) Kadmium tidak diendapkan dengan adanya sianida.
Kromium (Cr):
Sumber:
Kromium dapat hadir dalam air limbah sebagai kromium heksavalen (Cr 6+ ) dan kromium trivalen (Cr 3+ ). Sumber utama air limbah bantalan kromium adalah: unit pelapisan kromium, unit penyamakan krom, dan sistem air pendingin yang diolah dengan kromat.
Efek Beracun:
Kromium heksavalen beracun. Itu bisa menyebabkan kanker. Kromium trivalen tidak beracun seperti kromium heksavalen. Dalam limbah yang diolah, batas atas untuk Cr 3+ adalah 0,1 mg/L dan batas atas untuk Cr total adalah 2 mg/L ketika dibuang ke air permukaan daratan. Batasan total kromium dalam air minum adalah 0,05 mg/L.
Teknologi Perawatan:
Pengolahan air limbah yang mengandung kromium tergantung pada keadaan valensi kromium. Kromium heksavalen Cr 6+ , (misalnya, Na2 Cr2 O 7 atau Na 2 CrO 4 ) tidak dapat diendapkan sebagai hidroksida secara langsung; karenanya, itu harus dikurangi dengan teknologi apa pun selain curah hujan. Kromium trivalen Cr 3+ , (misalnya, Cr 2 (SO 4 ) 3 ) dapat dengan mudah dihilangkan sebagai endapan hidroksida.
Air limbah bantalan kromium heksavalen dapat diolah dengan salah satu dari metode berikut:
- Reduksi kromium heksavalen menjadi trivalen diikuti dengan pengendapan sebagai hidroksida,
- Proses pertukaran ion,
- Osmosis balik,
- Adsorpsi karbon.
- Proses Pengurangan-Pengendapan:
Ketika kromium heksavalen hadir dalam aliran air limbah bersama dengan beberapa logam berat, pemulihan dan penggunaan kembali akan sulit. Dalam kondisi ini Cr 6+ direduksi menjadi Cr 3+ pada pH 3,0 atau lebih rendah dengan menambahkan zat pereduksi yang sesuai. pH diatur dengan menambahkan asam sulfat. Salah satu dari agen pereduksi berikut dapat digunakan: sulfur dioksida (SO 2 ), natrium bi-sulfit (NaHSO 3 ), natrium meta-bi-sulfit (Na 2 S 2 O 5 ), natrium hidrosulfit (Na 2 S 2 O 5 ), dan besi sulfat (FeSO 4 ).
Sulfur dioksida lebih disukai sebagai zat pereduksi karena relatif murah. Ketika SO2 digunakan sebagai zat pereduksi, asam sulfat tidak perlu ditambahkan untuk pengaturan pH. Ketika salah satu dari garam natrium yang tercantum di atas digunakan sebagai zat pereduksi, TDS (total padatan terlarut) dari limbah yang diolah akan meningkat. Penggunaan besi sulfat sebagai zat pereduksi akan menghasilkan lebih banyak lumpur, karena besi hidroksida akan ikut diendapkan bersama dengan kromat hidroksida.
Pengolahan limbah Cr 6+ yang mengandung sianida dengan besi sulfat akan menghasilkan kompleks Ferosianida. Perlakuan selanjutnya dari kompleks tersebut akan sulit untuk pengurangan sianida. Reduksi Cr 6+ menjadi Cr 3+ tidak boleh dilakukan dengan adanya CN karena gas HCN yang sangat beracun akan dihasilkan selama proses tersebut.
Proses reduksi dapat dilakukan dalam dua tahap. Pada tahap pertama, salah satu dari zat pereduksi yang disebutkan di atas dapat digunakan dimana sebagian besar Cr 6+ akan direduksi. Pada tahap kedua, sisa Cr 6+ direduksi dengan hidrazin (N 2 H4). Setelah reduksi kromium trivalen (Cr 3+ ) diendapkan dengan kapur atau soda-abu sebagai hidroksida.
- Proses Pertukaran Ion:
Ketika diinginkan untuk memperoleh kembali Cr 6+ dari aliran air limbah, aliran tersebut pertama-tama dibebaskan dari padatan tersuspensi dan kemudian dilewatkan melalui tempat resin penukar anion. Pada saat kehabisan tempat tidur resin itu diregenerasi dengan larutan natrium hidroksida (NaOH).
Larutan terelusi yang mengandung natrium kromat (Na 2 CrO 4 ) harus dilewatkan melalui unggun penukar kation, yang akan menahan ion natrium dan membiarkan larutan asam kromat melewatinya. Sebelum langkah ini konsentrasi larutan Na2CrO4 harus disesuaikan sehingga larutan asam kromat yang dihasilkan tidak akan memiliki pH di bawah 4,0, karena pada pH di bawah 4,0 asam kromat yang dihasilkan akan menyerang partikel resin.
- Osmosis Balik:
Air limbah yang mengandung Cr 6+ terlebih dahulu dibebaskan dari padatan tersuspensi. Kemudian (Cr 6+ ) dapat dipekatkan menggunakan membran selulosa asetat yang sangat selektif. Pada pH sekitar 7, penolakan Cr 6+ mungkin sekitar 98%. Selain itu, pH netral akan mencegah hidrolisis asam pada membran.
- Adsorpsi Karbon:
Proses adsorpsi karbon dapat digunakan, hanya jika konsentrasi awal Cr 6+ dan logam berat lainnya rendah.
Kromium trivalen dapat dihilangkan dari air limbah baik dengan pengendapan sebagai kromat hidroksida atau dengan proses pertukaran ion :
Pengendapan biasanya dilakukan dengan penambahan kapur. Sebagai alternatif soda abu dapat digunakan. Kisaran pH optimum untuk pengendapan adalah 8,5-9,5. Endapan kromat hidroksida bersama dengan hidroksida logam lainnya dapat dipisahkan dari efluen yang diolah dengan sedimentasi diikuti dengan filtrasi.
Pertukaran ion dapat digunakan ketika kromium trivalen hadir bersama dengan kromat heksavalen dan dikromat, dan diinginkan untuk memulihkan dan menggunakan kembali asam kromat. Air limbah dari unit pelapisan krom pertama-tama dialirkan melalui tempat penukar kation, dimana Cr 3+ dan kation lainnya ditahan dan limbahnya akan mengandung asam kromat.
Kehati-hatian harus dilakukan selama langkah ini sehingga pH efluen yang diolah tidak akan turun di bawah 4,0 karena asam kromat akan mengoksidasi partikel resin. Ion Cr 3+ yang tertahan di unggun resin harus dielusi dengan asam, misalnya asam sulfat.
Sianida:
Sumber:
Air limbah bantalan sianida dihasilkan selama proses finishing logam, pelapisan logam dan ekstraksi perak dan emas. Sianida juga dapat hadir dalam pembuangan dari pabrik plastik dan pupuk.
Efek Beracun:
Ketika sekitar 50 sampai 60 mg sianida diambil sebagai dosis tunggal, itu menjadi fatal. Ketika tertelan pada dosis yang lebih rendah (katakanlah, 10 mg atau kurang) akan diubah menjadi tiosianat, yang tidak berbahaya. Sianida dapat menyebabkan kerusakan saraf atau masalah tiroid. Air limbah yang mengandung sianida pada pH asam menghasilkan gas HCN, yang sangat beracun. Limbah yang diolah ketika dibuang ke badan air permukaan daratan, tidak boleh mengandung lebih dari 0,2 mg/L sianida (sebagai CN) karena ikan dapat terbunuh pada konsentrasi yang jauh lebih rendah. Batasnya dalam air minum adalah 0,07 mg/L sebagai CN.
Teknologi Perawatan:
Metode yang dapat digunakan untuk pengurangan sianida adalah:
(a) Oksidasi,
(b) Dekomposisi elektrolitik,
(c) Pertukaran ion,
(d) Osmosis terbalik.
(a) Oksidasi:
Oksidasi sianida dengan klorin dilakukan dalam media basa.
Selama tahap pertama reaksi sianat dihasilkan seperti yang ditunjukkan di bawah ini:
NaCN + 2 NaOH + Cl 2 ——–>NaCNO + 2 NaCl + H 2 O …………..(10.1)
Untuk reaksi ini sekitar 1,75 kg Cl2 diperlukan per kg CN yang diolah. Selanjutnya sianat dioksidasi menjadi CO 2 dan N 2 . Reaksi dapat direpresentasikan sebagai
2NaCNO + 4NaOH + 3Cl 2 ——–>6NaCl + 2CO 2 + N 2 + 2H 2 O …………..(10.2)
Jumlah total Cl 2 yang diperlukan untuk oksidasi sempurna CN menjadi CO 2 dan N 2 adalah 4,3 kg per kg sianida. PH optimum untuk oksidasi klorin sianida adalah 8 hingga 9,5. Namun, jika logam lain hadir bersama dengan sianida, permintaan klorin akan lebih tinggi karena klorin dapat mengoksidasi beberapa logam yang ada. Beberapa logam seperti besi, nikel jika ada bersama dengan sianida membentuk kompleks yang stabil, yang sulit dioksidasi dengan Cl 2 . Ini dapat teroksidasi pada pH 10 + sekitar 90°C.
Oksidasi ozon sianida terjadi dalam dua langkah seperti dalam kasus oksidasi klorin. Mula-mula sianat dihasilkan, yang kemudian dioksidasi menjadi CO 2 dan N 2 . Untuk oksidasi lengkap sianida dibutuhkan sekitar 4,6-5 kg ozon per kg sianida. Reaksi pembentukan sianat sangat cepat pada pH 9-12, tetapi oksidasi sianat lebih lanjut relatif lambat. Kompleks sianida logam teroksidasi dengan adanya tembaga atau mangan, yang bertindak sebagai katalis.
(b) Dekomposisi Elektrolit:
Dekomposisi elektrolitik sianida dilakukan dengan menjadikannya oksidasi anodik. Ini adalah proses batch. Hal ini ekonomis jika konsentrasi sianida dalam likuor bekas (air limbah) tinggi dan jumlah air limbah yang akan diolah tidak terlalu besar, mula-mula dihasilkan sianat yang akhirnya diubah menjadi CO 2 , N 2 dan NH3.
Seiring berjalannya proses, konduktivitas rendaman (listrik) menurun dan proses melambat. Akhirnya, mungkin ada sisa sianida. Namun, jika air limbah mengandung natrium klorida (NaCl) atau NaCl ditambahkan ke dalamnya, maka laju oksidasi meningkat karena peningkatan konduktivitas larutan dan pembentukan gas klorin yang ikut serta dalam proses oksidasi. Proses ini mampu menghancurkan kompleks logam sianida. Salah satu kelemahan dari proses ini adalah penskalaan anoda (fouling) dengan adanya ion sulfat dalam air limbah yang akan diolah.
(c) dan (d) Pertukaran Ion dan Reverse Osmosis:
Pertukaran ion dan reverse osmosis belum ditemukan memuaskan untuk pengolahan air limbah yang mengandung sianida, karena pengotoran terjadi karena pengendapan logam sianida. Kelemahan lainnya adalah kerusakan resin dan membran oleh sianida.
Fluor:
Sumber:
Fluorida hadir dalam air alami (air tanah) di beberapa daerah. Proses industri tertentu, seperti produksi asam fosfat, produksi super fosfat, produksi aluminium, dan produksi kaca menghasilkan air limbah yang mengandung fluorida.
Air limbah dari finishing logam, elektroplating, manufaktur semi-konduktor dan unit benefisiasi bijih juga mengandung fluorida. Air limbah dari finishing logam, elektroplating, manufaktur semi-konduktor dan unit benefisiasi bijih juga mengandung fluorida.
Efek Beracun:
Fluorida yang terdapat dalam air minum dengan konsentrasi lebih dari 3 mg/L dapat menyebabkan fluorosis gigi. Air yang mengandung 8 hingga 20 mg/L fluoride, jika dikonsumsi dalam jangka waktu lama, akan menyebabkan perubahan tulang dan dapat menyebabkan fluorosis yang melumpuhkan.
Air minum yang memiliki kandungan fluoride optimal 0,7 hingga 1,2 mg/L mencegah karies gigi selama masa kanak-kanak. Batas atas adalah 1,5 mg/L. Air limbah terolah yang mengandung maksimum 2 mg/L fluorida (F) yang dapat dibuang ke badan air permukaan daratan.
Teknologi Perawatan:
Beberapa metode telah dikembangkan untuk pengolahan air limbah bantalan fluorida.
Ini dapat diklasifikasikan menjadi dua kelompok:
(a) presipitasi/kopresipitasi
(b) Adsorpsi.
(a) Presipitasi/Kopresipitasi
Bahan kimia yang telah ditemukan efektif dalam meredam fluoride dalam air limbah sebagai endapan, adalah kapur, dolomit dan tawas. Endapan dipisahkan dengan sedimentasi dan filtrasi. Pada penambahan kapur pada air limbah yang mengandung fluorida kalsium fluorida, CaF 2 , terbentuk yang kelarutannya dalam air rendah. Ketika fluor hadir sebagai fluorida, waktu reaksi 30 menit sudah cukup. Tetapi ketika ada kompleks fluorida—kompleks tersebut mula-mula dihidrolisis dan kemudian ion fluorida bereaksi dengan kapur membentuk CaF 2 . Total waktu reaksi mungkin 24 jam.
Laju pembentukan endapan lambat, sehingga membutuhkan waktu yang relatif lebih lama untuk mencapai batas kelarutan konsentrasi fluoride (sekitar 8 mg/L sebagai F pada 18 °C). Pada dosis kapur yang lebih tinggi (dibandingkan jumlah stoikiometri), konsentrasi fluorida sisa dapat menjadi kurang dari batas kelarutannya. Kapur (Ca (OH) 2 ) dan CaCl 2 biasanya ditambahkan. pH antara 8 dan 9 atau di atas 12 meminimalkan kelarutan CaF 2 dalam air.
Penambahan senyawa tawas atau magnesium pada kisaran pH 6,5 hingga 7,5 menyebabkan kopresipitasi fluorida bersama dengan hidroksida aluminium/magnesium. Jumlah tawas yang dibutuhkan tergantung pada konsentrasi fluoride awal, konsentrasi fluoride akhir yang diinginkan dan pH. Dalam kondisi basa kebutuhan tawas meningkat. Strategi terbaik untuk menghilangkan fluoride dengan pengendapan adalah mengolahnya dengan kapur diikuti dengan tawas, karena kapur jauh lebih murah daripada tawas.
(b) Adsorpsi:
Proses adsorpsi dapat digunakan untuk menghilangkan fluoride dari air limbah. Prosesnya terdiri dari melewatkan aliran air limbah yang mengandung fluoride melalui hamparan partikel granular (baik resin penukar anion tipe basa lemah atau alumina aktif). Ketika unggun penukar anion digunakan, anion selain fluorida juga ditangkap.
Untuk regenerasi partikel resin penukar ion, larutan alkali (NaOH)/amonia (NH 4 OH) dapat digunakan. Lapisan alumina aktif akan menghilangkan fluorida dan arsenik (jika ada). Lapisan alumina bekas diregenerasi dengan larutan soda kaustik (NaOH). Larutan regeneran bekas dari resin penukar ion/bed alumina aktif dinetralkan dengan asam sulfat/hidroklorat encer.
Proses adsorpsi dapat hemat biaya untuk pengolahan air limbah fluoride tingkat rendah. Perlu dicatat di sini bahwa kompleks fluoride tidak dapat dikurangi dengan proses adsorpsi. Air limbah yang memiliki konsentrasi fluoride lebih tinggi harus diolah dengan proses dua tahap. Mula-mula bahan ini harus diolah dengan kapur untuk menurunkan konsentrasi fluorida menjadi sekitar 8 mg/L dan kemudian harus dikenakan adsorpsi sehingga memiliki konsentrasi fluorida akhir sekitar 1 mg/L atau kurang.
Logam Berat:
Logam berat yang biasanya ada dalam air limbah dapat diklasifikasikan ke dalam dua kelompok berikut tergantung pada potensi pencemarannya:
- Logam yang memiliki potensi pencemaran yang sangat tinggi, seperti
Perak (Ag), Emas (Au), Kadmium (Cd), Tembaga (Cu), Merkuri (Hg), Timbal (Pb), Antimon (Sb), Timah (Sn), Telurium (Te), Seng (Zn);
- Logam yang memiliki potensi pencemaran tinggi, seperti
Barium (Ba), Bismut (BI), Besi (Fe), Mangan (Mn), Molibdenum (Mo), Titanium (Ti), Uranium (U),
Harus ditunjukkan di sini bahwa klasifikasi yang disebutkan di atas bukanlah klasifikasi yang lengkap.
Sumber:
Air limbah yang dihasilkan selama operasi penambangan, benefisiasi bijih, pemrosesan logam, pelapisan listrik dan produksi serta penggunaan bahan kimia anorganik kemungkinan besar mengandung satu atau lebih logam beracun. Air tanah di beberapa tempat juga mengandung logam beracun. Operasi industri yang menggunakan bahan kimia anorganik yang mengandung logam beracun akan menghasilkan air limbah yang mengandung logam tersebut.
Efek Beracun:
Logam berat pada umumnya bersifat racun. Beberapa bersifat karsinogenik. Ini menumpuk di tubuh manusia dan menghasilkan efek racun yang serius. Untuk beberapa logam batas atas dalam air minum serendah 0,01 mg/L atau masih kurang.
Teknologi Perawatan:
Metode yang dapat diterapkan untuk menghilangkan logam dari air limbah adalah:
(a) Curah hujan
(b) Adsorpsi karbon,
(c) Proses pertukaran ion, dan
(d) Osmosis balik,
(a) Curah hujan:
Dari berbagai metode yang tersedia untuk menghilangkan logam dari air limbah, presipitasi kimia sangat sering digunakan, karena paling murah. Sebagian besar logam dapat diendapkan sebagai hidroksida atau sulfida. Endapan dipisahkan dengan pengendapan, dan dengan lapisan pasir atau filtrasi media tikus. Konsentrasi sisa suatu logam setelah pengendapan bergantung pada hasil kali kelarutan senyawa yang terbentuk (endapan).
Untuk endapan hidroksida hasil kali kelarutan dinyatakan sebagai [M n+ ] x [OH n- ] = K. Secara umum, ketika pH meningkat, konsentrasi ion logam sisa dalam air yang diolah menurun. Namun, untuk setiap logam tertentu terdapat pH optimum di mana konsentrasi sisa ion logam adalah minimum. Untuk beberapa logam dimungkinkan untuk mengurangi konsentrasi ion logam sisa di bawah yang diperkirakan oleh produk kelarutannya masing-masing. Ini mungkin karena adsorpsi ion logam oleh kawanan kimia.
Harus disebutkan di sini bahwa ketika logam hadir dalam air limbah sebagai senyawa organologam, pengurangannya dengan pengendapan kapur mungkin tidak begitu efektif. Koagulasi tawas (kopresipitasi bersama dengan Al(OH) 3 pada pH mendekati netral juga menghasilkan beberapa hidroksida logam. Kopresipitasi besi hidroksida pada logam menghasilkan penyisihan yang lebih baik. Untuk beberapa logam, reaksi presipitasi sulfida lebih efektif dalam mengurangi residunya. tingkat konsentrasi dibandingkan dengan masing-masing reaksi pengendapan hidroksida Produk kelarutan logam sulfida dapat dinyatakan sebagai
[M m+ ] x [S n- ] = K
Konsentrasi sisa logam untuk reaksi presipitasi sulfida bergantung pada pH. Setiap logam memiliki pH tertentu di mana konsentrasi residunya minimum. Reagen yang digunakan untuk presipitasi sulfida adalah hidrogen sulfida (H 2 S) atau natrium sulfida (Na 2 S).
Penghapusan beberapa logam berat baik sebagai hidroksida atau sebagai sulfida mungkin buruk, oleh karena itu diendapkan sebagai beberapa garam yang sedikit larut. Beberapa contoh spesifik disebutkan di bawah ini.
Penghapusan perak (Ag) sebagai klorida (AgCl) sangat efektif karena kelarutannya dalam air pada suhu 25 °C hanya 1,4 mg/L. Barium (Ba) dapat diendapkan sebagai barium sulfat dimana konsentrasi sisa dapat diturunkan menjadi sekitar 0,5 mg/L. Ion besi (Fe) dapat dihilangkan secara efektif sebagai hidroksida, tetapi ion besi harus terlebih dahulu dioksidasi menjadi bentuk besi dengan klorinasi dan kemudian diendapkan sebagai hidroksida.
Dari senyawa mangan (Mn) yang berbeda mangan oksida (MnO 2 ) dan hidroksida tidak larut. Untuk menghilangkan ion monogami yang teroksidasi dan kemudian diendapkan sebagai oksida atau hidroksida. Oksidasi dapat dilakukan dengan udara (dengan adanya tembaga sebagai katalis) pada pH 8,5-10 atau dengan klorin/klorin dioksida pada pH 9-10 atau dengan ozon dengan adanya kapur Nikel (Ni) dapat diendapkan baik sebagai hidroksida atau sulfida. Timbal (Pb) dihilangkan baik sebagai karbonat atau sebagai endapan hidroksida. Selenium (Se) dapat diendapkan dari air limbah sebagai sulfida pada pH 6,6.
(b) Adsorpsi Karbon:
Proses adsorpsi karbon aktif seperti itu kurang efektif dalam menghilangkan ion logam dari air limbah. Namun, ketika air limbah mengandung senyawa organik terlarut dan dihilangkan dengan proses adsorpsi karbon aktif, beberapa ion logam ikut terserap. Dengan demikian proses ini bukanlah metode yang efektif untuk pengurangan ion logam berat dari air limbah.
(c) Proses Pertukaran Ion:
Proses pertukaran ion dapat digunakan untuk menghilangkan logam berat yang ada dalam air limbah hanya dalam keadaan ionik. Proses tersebut tidak dapat menghilangkan senyawa organologam. Ini menjadi proses yang lebih mahal dapat digunakan baik untuk menghilangkan ion sisa setelah pengendapan atau untuk pemulihan logam dari air limbah.
(d) Osmosis Balik:
Reverse osmosis dapat digunakan untuk pemisahan logam berat yang ada dalam keadaan ionik serta senyawa organologam. Ini adalah proses yang lebih mahal dan karenanya dapat digunakan jika ternyata ekonomis atau jika proses yang dibahas sebelumnya ternyata tidak memadai.
Merkuri (Hg):
Sumber:
Proses utama yang menimbulkan air limbah yang mengandung merkuri adalah :
(i) Elektrolisis air garam untuk produksi soda kaustik,
(ii) Produksi senyawa yang mengandung merkuri,
(iii) Pemulihan pertambangan dan pemurnian merkuri, dan
(iv) Produksi fungisida dan obat-obatan. Pembuangan air limbah dari kilang juga mengandung merkuri.
Efek Beracun:
Merkuri sangat beracun. Ini merusak otak, sistem saraf pusat dan ginjal. Batas atas konsentrasinya dalam air limbah yang diolah adalah 0,01 mg/L, ketika dibuang ke air permukaan daratan. Batasnya dalam air minum adalah 1 µgL.
Teknologi Perawatan:
Dari berbagai teknologi pengolahan yang dilaporkan dalam literatur, yang paling umum digunakan adalah:
(a) Curah hujan,
(b) Adsorpsi karbon,
(c) Pengurangan
(d) Pertukaran ion dan
(e) Koagulasi.
Pengendapan:
Merkuri yang ada dalam air limbah sebagai ion merkuri dapat diendapkan sebagai sulfida pada pH basa. Senyawa merkuri lainnya perlu dioksidasi menjadi merkuri sebelum presipitasi. Pereaksi yang dapat digunakan untuk presipitasi sulfida adalah natrium sulfida (Na 2 S), dan natrium hidrogen sulfida (NaHS).
Endapan dapat dipisahkan dengan flokulasi, pengendapan gravitasi, filtrasi dan pengapungan udara terlarut. Konsentrasi merkuri minimum yang dapat dicapai bahkan setelah pengendapan diikuti dengan pemisahan endapan dan pemolesan karbon aktif adalah sekitar 10-20 µg/L.
Kelemahan lain dari proses presipitasi sulfida adalah:
(i) Pembentukan kompleks merkuri sulfida terlarut dengan adanya reagen berlebih, dan
(ii) Kesulitan dalam memantau kelebihan kandungan sulfida dalam limbah yang diolah.
Pengendapan bersama merkuri hidroksida dengan aluminium hidroksida dapat mengurangi tingkat residu merkuri menjadi sekitar 1-10 µg/L. Pengendapan bersama dengan besi hidroksida dapat menurunkan tingkat residu menjadi sekitar 0,5-5 µg/L.
(b) Adsorpsi Karbon:
Adsorpsi karbon aktif dapat digunakan sebagai langkah pemolesan.
Efektivitasnya tergantung pada faktor-faktor berikut:
(i) Bentuk awal dan konsentrasi merkuri yang ada dalam air limbah,
(ii) Dosis dan jenis karbon aktif bubuk yang digunakan, dan
(iii) Periode kontak antara partikel karbon dan air limbah yang mengandung merkuri.
Metode ini lebih efektif dalam menghilangkan senyawa merkuri organik daripada senyawa merkuri anorganik. Efektivitas proses dapat ditingkatkan jika presipitasi besi hidroksida atau aluminium hidroksida dilakukan secara bersamaan. Penambahan poli-elektrolit juga membantu.
(c) Pengurangan:
Merkuri yang ada dalam air limbah sebagai merkuri ionik anorganik dapat direduksi menjadi bentuk logamnya dengan menggunakan zat pereduksi, seperti aluminium, seng, hidrazin, stannous klorida, dan natrium borohidrat. Merkuri logam yang dihasilkan dapat diperoleh kembali dengan teknik pemisahan padat yang sesuai. Kerugian utama dari proses ini adalah tidak dapat mencapai tingkat residu merkuri jauh di bawah 100 µg/L.
(d) Proses Pertukaran Ion:
Jenis resin khusus digunakan untuk menghilangkan merkuri dari air limbah. Ketika garam mercurous atau senyawa merkuri organik hadir dalam air limbah, mereka dioksidasi dengan klorin dimana kompleks merkuri klorida bermuatan negatif dihasilkan. Ini dapat dihilangkan dengan menggunakan resin penukar anion.
Dengan tidak adanya konsentrasi klorida yang tinggi dalam air limbah, merkuri anorganik dapat dihilangkan dengan menggunakan resin penukar kation. Proses pertukaran ion paling baik dapat menurunkan tingkat konsentrasi merkuri anorganik menjadi sekitar 1-5 (Jg/L. Proses ini tidak terlalu efektif untuk pengurangan senyawa merkuri organik dalam air limbah.
(e) Koagulasi:
Aluminium sulfat, garam besi dan kapur ditemukan lebih baik daripada tawas. Peningkatan dosis koagulan melebihi 100-150 mg/L tidak meningkatkan pembuangan merkuri. Proses koagulasi telah diamati tidak efektif dalam penghilangan metil merkuri.
Nutrisi:
Aliran air limbah yang mengandung senyawa nitrogen (N) dan fosfor (P) ketika dibuang ke badan air mendorong pertumbuhan tanaman air yang tidak terkendali. Karena itu, senyawa tersebut disebut sebagai nutrisi. Pertumbuhan tanaman air yang tidak terkendali di badan air, seperti kolam, sungai, dan saluran sering menyebabkan eutrofikasi. Oleh karena itu perlu untuk mengurangi senyawa tersebut dari aliran air limbah sebelum dibuang ke badan air permukaan.
Sumber:
Sumber utama air limbah industri yang mengandung senyawa nitrogen adalah unit pembuatan pupuk nitrogen, pabrik oven kokas, unit pembuatan asam nitrat dan garam nitrat/nitrit, unit pemrosesan ikan dan daging, dll. Air limbah yang mengandung fosfor dihasilkan terutama selama produksi asam fosfat , pupuk fosfat, dan senyawa organofosfor.
Efek Beracun:
Air limbah yang mengandung senyawa nitrogen dan fosfor, ketika dibuang ke badan air, mendorong pertumbuhan tanaman air termasuk alga. Ini dapat menyebabkan pertumbuhan subur mereka, yang disebut sebagai mekar alga. Tumbuhan air memanfaatkan oksigen terlarut (DO) untuk respirasi dan dengan demikian menghabiskannya.
Pada tahap tertentu laju re-oksigenasi menjadi kurang dari laju penipisan oksigen dan konsentrasi DO menjadi terlalu rendah bagi tanaman air untuk bertahan hidup. Mereka mulai membusuk. Akhirnya badan air menjadi berbau busuk dan mengandung bahan organik yang membusuk/terurai. Ini disebut sebagai kondisi eutrofik.
Secara umum, senyawa nitrogen dan fosfor yang ada dalam air limbah menyebabkan efek buruk yang disebutkan di atas. Namun, air limbah dari beberapa industri mungkin mengandung beberapa senyawa nitrogen dan fosfor tertentu yang beracun bagi flora dan fauna air.
Batas atas untuk nitrat adalah 50 mg/L (sebagai NO 3 ) dan untuk nitrit adalah 3 mg/L (sebagai NO 2 ) untuk paparan jangka pendek dalam air minum. Perlu dicatat di sini bahwa nitrat direduksi menjadi nitrit karena aksi bakteri di usus. Nitrit yang dihasilkan bergabung dengan hemoglobin untuk membentuk kompleks, yang mengurangi daya dukung oksigen darah.
Teknologi Perawatan:
Metode yang dapat digunakan untuk menghilangkan senyawa nitrogen dan fosfor dari air limbah adalah polutan spesifik seperti yang dijelaskan di bawah ini:
Penghapusan Nitrogen:
Nitrogen dapat hadir dalam air limbah sebagai amonia (dalam keadaan bebas atau gabungan), nitrit, nitrat, asam amino dan senyawa organik nitrogen lainnya.
Salah satu dari metode berikut atau kombinasi dari beberapa metode tersebut dapat digunakan untuk menghilangkan senyawa yang disebutkan di atas dari aliran air limbah:
(a) Pengupasan udara,
(b) Oksidasi,
(c) Metode biologis,
(d) Adsorpsi,
(e) Pertukaran ion dan
(f) Pemisahan membran.
(a) Pengupasan Udara:
Metode ini dapat digunakan untuk menghilangkan amonia bebas (NH 4 OH) dari air limbah. Prosesnya terdiri dari air limbah dan udara yang saling berhubungan secara berlawanan dalam kolom yang dikemas. Air limbah yang dibebaskan dari padatan tersuspensi dimasukkan di bagian atas kolom di mana udara diinjeksikan di bagian bawah. Aliran udara yang meninggalkan kolom di bagian atas akan mengandung amonia, dan zat volatil lainnya (jika ada) yang ada dalam air limbah.
Karena campuran udara-amonia yang meninggalkan kolom di bagian atas tidak dapat dibuang tanpa diolah ke atmosfir, maka harus mengalami salah satu atau kombinasi dari proses berikut untuk pemulihan/penghancuran konstituen yang dilucuti: pendinginan/penggosokan/oksidasi ( pembakaran).
Untuk menghilangkan amonia dari air limbah ketika hadir sebagai garam, air limbah harus diolah terlebih dahulu dengan kapur dan kemudian dilakukan pengupasan udara. Pendinginan/penggosokan campuran udara-amonia menghasilkan pemulihan amonia sebagai larutan sedangkan insinerasi mengubah amonia menjadi N2 dan H2O. Pemulihan amonia dengan pengupasan udara mungkin ekonomis ketika konsentrasi garam amonia/amonium dalam air limbah relatif tinggi.
(b) Oksidasi:
Klorinasi Titik Istirahat:
Amonia dalam air limbah mengalami reaksi berikut ketika diklorinasi pada pH 6 sampai 7:

Kontrol pH yang tidak tepat dapat menyebabkan pembentukan nitrogen tri-klorida (gas). Hidrokarbon terlarut yang ada dalam air limbah dapat menghasilkan tri-klorometana, zat beracun. Beberapa polutan selain amonia yang terdapat dalam air limbah juga dapat bereaksi dengan klorin sehingga meningkatkan konsumsi klorin, yang akan mengakibatkan biaya pengolahan yang lebih tinggi. Metode ini ekonomis, hanya jika konsentrasi amonia dalam air limbah pada awalnya rendah atau telah dikurangi dengan beberapa perlakuan lain. Ini memiliki keuntungan tambahan bahwa desinfeksi dilakukan secara bersamaan. Perhatian harus diberikan agar limbah yang diolah tidak mengandung residu klorin yang tinggi.
(c) Metode Biologis:
Kedua senyawa nitrogen anorganik dan organik kecuali rekalsitran dan non-biodegradable dapat dikurangi dengan metode biologis. Selama proses ini, sebagian dari total nitrogen yang ada dalam air limbah diasimilasi untuk mensintesis mikroba sementara sebagian lainnya dikatabolisme. Prosesnya dilakukan dalam dua tahap. Selama tahap pertama (aerobik), bakteri Nitrosomonas dan Nitrobacter mengoksidasi senyawa nitrogen menjadi nitrit (NO 2 ) dan nitrat (NO3). Reaksi dapat dinyatakan sebagai
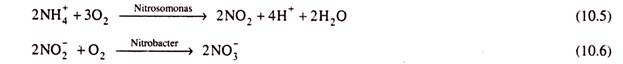
Sedangkan selama tahap kedua (anaerobik) nitrit dan nitrat diubah menjadi gas seperti N 2 , NO, NO 2 , N 2 O, dll. Terutama, N 2 diproduksi. Mikroba yang melakukan reaksi ini adalah Achromobacter, Aerobacter, Alcaligenes, Bacillus, Flabobactrium, Micrococus, Proteus, Pseudomonous, dll. Perlakuan aerobik (nitrifikasi) dan anaerobik (denitrifikasi) air limbah yang mengandung senyawa nitrogen telah dibahas dalam Bagian. 9.11.3.2 dan 9.11.3.3. Harus ditunjukkan di sini bahwa metode biologis untuk pengolahan polutan nitrogen dalam air limbah hemat biaya bahkan ketika konsentrasinya tinggi.
(d) Adsorpsi:
Metode adsorpsi karbon aktif mampu menghilangkan senyawa nitrogen anorganik dan organik. Ini lebih efektif untuk pengurangan senyawa organik termasuk rekalsitran dan non-biodegradable. Tingkat penghilangan spesifik adsorben-adsorbat. Itu juga tergantung pada faktor-faktor seperti suhu, pH, waktu ruang dan adsorbat lain (polutan) yang ada, jika ada.
Baik karbon aktif bertenaga atau granular dapat digunakan. Pada permukaan dan mikrospora partikel karbon, adsorbat akan teradsorpsi. Setelah partikel menjadi jenuh dengan adsorbat, partikel dapat diregenerasi (dibebaskan dari adsorbat) dan digunakan kembali atau dibuang. Ketika bubuk karbon digunakan, tidak diperlukan pengolahan awal air limbah untuk pemisahan partikel tersuspensi.
Partikel karbon bubuk biasanya dibuang setelah digunakan. Partikel karbon butiran digunakan dalam unggun yang dikemas di mana air limbah yang akan diolah mengalir ke arah bawah. Untuk menghindari tersumbatnya packed bed, aliran air limbah harus diolah terlebih dahulu untuk menghilangkan partikel tersuspensi yang ada, jika ada. Partikel karbon granular biasanya dibuat ulang dan digunakan kembali. Metode ini menjadi relatif mahal dapat digunakan ketika polutan hadir pada konsentrasi rendah atau ketika metode lain tidak efektif.
(e) Metode Pertukaran Ion:
Metode ini dapat digunakan untuk menghilangkan radikal nitrogen terionisasi seperti NH + 4 , NO – 3 , NO – 2 yang ada dalam air limbah. Senyawa nitrogen yang tidak terionisasi tidak dapat dihilangkan dengan metode ini. Prosesnya dilakukan dengan mengalirkan air limbah yang bebas dari partikel tersuspensi melalui kolom yang mengandung partikel resin kationik/anionik tergantung pada jenis ion yang akan dihilangkan. Saat air limbah mengalir melalui resin bed, ion (kation/anion) dalam larutan ditahan dan partikel resin menjadi jenuh secara bertahap.
Setelah partikel menjadi benar-benar jenuh, tidak ada lagi penghilangan ion yang terjadi. Sebelum keadaan seperti itu tercapai, proses dihentikan dan partikel resin dibuat ulang dengan perlakuan kimia. Selama proses ini tidak hanya ion nitrogen tetapi juga ion anorganik dan organik lainnya (jika ada) akan dipertahankan oleh partikel resin dan karenanya beban pada alas resin akan menjadi tinggi.
(f) Pemisahan Membran:
Dalam proses ini air limbah yang bebas dari partikel tersuspensi tetapi mengandung zat terlarut dibiarkan mengalir di atas lembaran atau tabung polimer (membran) yang disiapkan khusus. Melalui dinding lembaran/tabung air merembes ke sisi lain sedangkan zat terlarut dipertahankan.
Proses ini mampu memisahkan zat terlarut anorganik dan organik dari air. Itu tidak efektif biaya kecuali aliran air limbah mengandung zat terlarut pada konsentrasi rendah. Zat terlarut yang tertahan bersama dengan beberapa aliran air keluar dari unit, yang disebut sebagai retentate.
Penghapusan Fosfor :
Fosfor dapat hadir dalam air limbah sebagai metafosfat (PO 3 – ), ortofosfat (PO 4 -3 ). pirofosfat (P 2 O 7 -4 ). tripolifosfat (P 3 O -5 10 ) dan senyawa organofosfor. Sumber air limbah yang mengandung fosfor adalah unit yang memproduksi asam fosfat, pupuk fosfat, berbagai senyawa fosfor, deterjen, pestisida (insektisida, herbisida, dan fungisida), dll.
Metode utama yang dapat digunakan untuk pengurangan senyawa fosfor dari air limbah adalah (a) presipitasi, dan (b) pengolahan biologis. Metode lain untuk menghilangkan fosfor adalah adsorpsi karbon, pertukaran ion dan pemisahan membran. Metode yang terakhir relatif mahal dan karenanya dapat digunakan untuk menghilangkan senyawa rekalsitran saja.
(a) Curah hujan:
Penambahan garam logam atau kapur ke air limbah yang mengandung ion ortofosfat (PO 3- ) menghasilkan pembentukan logam fosfat yang sedikit larut, yang mengendap. Kelarutan logam fosfat tergantung pada pH. A1PO 4 memiliki kelarutan minimum pada pH 6,5; FePO 4 memiliki kelarutan minimum pada pH 5,3.
Ferro fosfat [Fe 3 (PO 4 ) 2 ] dan kalsium fosfat [Ca 3 (PO 4 )2] memiliki kelarutan yang rendah pada nilai pH yang lebih tinggi. Kapur bereaksi dengan alkalinitas air limbah dan mengendap sebagai CaCO3. Ketika tingkat pH meningkat melebihi 10, ion Ca 2+ bereaksi dengan ion fosfat dan mengendap sebagai Ca 5 (PO 4 ) 3 OH. Reaksi presipitasi hampir seketika. Mungkin ada beberapa reaksi samping yang mengarah pada pembentukan dan pengendapan senyawa lain seperti yang tercantum dalam Tabel 10.1
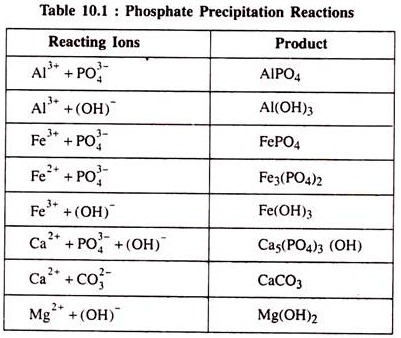
Harus ditunjukkan di sini bahwa sangat sedikit senyawa polifosfat dan organofosfor yang dihilangkan bersama dengan endapan fosfor. Garam logam yang ditambahkan (untuk penghilangan fosfat) melebihi jumlah stoikiometri akan tetap berada dalam larutan sebagai akibatnya kandungan padatan terlarut total dari limbah yang diolah akan meningkat.
Larutan air garam besi dan aluminium biasanya ditambahkan untuk pengendapan fosfat. Lebih mudah untuk menangani, menyimpan, dan memberi dosis. Tingkat dosis dipastikan dengan uji laboratorium. Kapur dapat ditambahkan sebagai bubur. Penyimpanan, penanganan, dan pemberian dosisnya agak sulit. Selain itu, jumlah lumpur yang dihasilkan akan lebih besar. Oleh karena itu penggunaannya untuk pengendapan fosfat menurun meskipun harganya lebih murah daripada garam besi dan aluminium.
Jika konsentrasi awal ion PO 3-4 tinggi dalam aliran air limbah, maka fosfat dapat diendapkan selama pengolahan primer. Senyawa fosfat lainnya termasuk senyawa organo fosfor dapat dihilangkan dengan pengendapan, hanya setelah/selama pengolahan sekunder karena diubah menjadi PO 3-4 adalah hasil dari reaksi biologis.
Endapan yang dihasilkan selama pengolahan primer/sekunder dipisahkan dalam alat pengklasifikasi dan dibuang sebagai lumpur. Senyawa fosfor yang lolos dari penghilangan oleh presipitasi dapat dihilangkan dengan adsorpsi karbon dan/atau proses pemisahan membran.
(b) Perawatan Biologis:
Pengolahan biologis air limbah yang mengandung fosfor dilakukan dengan melakukan proses aerobik dan anaerobik secara bergantian. Selama pengolahan biologis, sebagian senyawa fosfor dan nitrogen yang terdapat dalam air limbah berasimilasi untuk sintesis sel-sel baru.
Dalam kondisi aerobik, senyawa fosfor yang dapat terbiodegradasi termasuk yang organik dioksidasi menjadi ortofosfat dan polifosfat, beberapa di antaranya disimpan dalam mikroba. Selama pengolahan anaerobik, senyawa fosfor yang disimpan (ortofosfat dan polifosfat) dilepaskan ke dalam air.
Senyawa Fosfor yang dilepaskan dapat dibuang dengan lumpur sekunder atau diendapkan sebelum pemisahan dan pembuangan lumpur. Dapat disimpulkan dengan mengatakan bahwa untuk menghilangkan fosfor secara biologis, pengolahan air limbah anaerobik dan aerobik sangat penting.
Beberapa proses komersial telah dikembangkan dan digunakan untuk penyisihan fosfor biologis di mana langkah-langkah anaerobik dan aerobik diurutkan dalam urutan yang berbeda. Beberapa di antaranya telah dibahas dalam Bagian 9.11.3.4. Harus ditunjukkan di sini bahwa selama proses penghilangan fosfor secara biologis, urutan yang tepat dari langkah-langkah anaerobik dan aerobik akan mengarah pada pengurangan beberapa senyawa nitrogen serta BOD.
Fenol:
Sumber:
Fenol (C 6 H 5 OH) juga dikenal sebagai asam karbol. Sumber utama air limbah yang mengandung fenol adalah: kilang minyak bumi, pabrik oven kokas, pabrik fenol sintetik dan tanaman yang memproduksi resin fenolik, senyawa fenolik dan tanaman yang menggunakan fenol sebagai bahan baku.
Efek Beracun:
Fenol bersifat korosif dan beracun bagi semua makhluk hidup. Ketika limbah yang diolah dibuang ke badan air permukaan pedalaman, konsentrasi fenol tidak boleh melebihi 1 mg/L. Dalam air minum batasnya adalah 0,001 mg/L.
Teknologi Perawatan:
Beberapa metode pengolahan kimia, fisika dan biologi digunakan untuk menghilangkan fenol dan senyawa fenolik dari air limbah.
Ini dibahas di bawah:
(i) Pengolahan larutan pekat,
(ii) Pengolahan larutan dengan konsentrasi menengah, dan
(iii) Pengobatan larutan encer.
Sebelum upaya dilakukan untuk menghilangkan fenol dari aliran air limbah, diperlukan perlakuan awal untuk menghilangkan bahan tersuspensi, logam berat (bila ada pada konsentrasi tinggi), minyak, sianida, dll.
(i) Larutan Terkonsentrasi:
Air limbah yang mengandung fenol dengan konsentrasi di atas 500 mg/L dianggap sebagai larutan pekat. Karena fenol yang diperoleh kembali memiliki nilai pasar, ia dapat diperoleh kembali dari air limbah dengan ekstraksi pelarut.
Proses yang digunakan secara komersial adalah: defenolisasi Benzena-kaustik, defenolisasi Fenosolvan (Lurgi), dan defenolisasi IFAWOL. Proses ini memiliki efisiensi penghilangan fenol yang tinggi (98-99%). Perlu ditekankan di sini bahwa benzena sebagai zat karsinogenik, penggunaannya sebagai pelarut memerlukan penanganan yang sangat hati-hati.
Tergantung pada konsentrasi awal fenol dalam air limbah, konsentrasi sisa setelah ekstraksi mungkin 10-30 mg/L atau lebih. Residu fenol dapat dihilangkan dengan salah satu atau kombinasi dari perlakuan berikut: biologis, adsorpsi karbon aktif, koagulasi dengan tawas/garam besi, oksidasi kimia dengan permanaganat/Klorin/Klorin dioksida/ozon.
(ii) Larutan Konsentrasi Menengah:
Air limbah yang memiliki konsentrasi fenol dalam kisaran 50-500 mg/L diberi label sebagai larutan konsentrasi menengah. Larutan tersebut dapat diolah dengan proses biologis (aerobik) yang sesuai, seperti laguna, selokan oksidasi, trickling filter, pengolahan lumpur aktif. Perlakuan biologis dapat menurunkan konsentrasi fenol menjadi sekitar 0,5-1 mg/L.
Metode pengobatan alternatif lainnya adalah:
(a) Adsorpsi karbon aktif, yang sama efektifnya dengan metode biologis,
(b) Koagulasi dengan garam tawas/besi pada pH yang sesuai—efektivitasnya agak buruk, dan
(c) Oksidasi kimia.
Oksidasi kimia dapat dilakukan baik dengan permanganat, yang merupakan bahan kimia mahal atau dengan klorin dan kapur pada pH kurang dari 7. Ini sangat efektif. Namun, sejumlah besar klorin harus digunakan untuk memastikan oksidasi sempurna fenol, karena klorofenol beracun akan dihasilkan.
Oksidasi dapat dilakukan dengan klorin dioksida, yang merupakan oksidan kuat dan cukup efektif dalam mengoksidasi fenol dan senyawa fenolik. Namun, kemungkinan konversi menjadi klorat (yang beracun bagi manusia) membuat penggunaannya dalam pengolahan air minum dipertanyakan.
Oksidasi juga dapat dilakukan dengan sangat efektif dengan ozon. Ini adalah oksidan yang sangat kuat dan tidak menghasilkan produk sampingan yang berbahaya. Untuk oksidasi 1 bagian fenol diperlukan sekitar 1,5 hingga 2,5 bagian ozon. Residu fenol setelah perawatan ozon mungkin serendah 3 ppb.
(iii) Larutan Encer:
Air limbah yang mengandung fenol kurang dari 50 mg/L dianggap sebagai larutan encer. Larutan tersebut dapat diolah secara biologis atau dengan karbon aktif atau dengan oksidasi ozon. Kesulitan utama dalam perawatan ozon adalah bahwa ozon dihasilkan secara in situ.
Senyawa Organik Volatile (VOC):
Senyawa organik yang ada dalam air limbah mungkin dari jenis berikut:
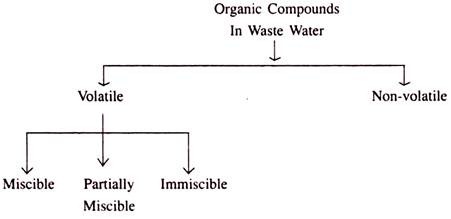
Senyawa volatil dapat terurai secara hayati atau tidak dapat terurai secara hayati. Senyawa yang tidak mudah menguap pada umumnya tidak dapat terurai secara hayati.
Sumber:
Sumber industri utama air limbah yang mengandung VOC adalah kilang minyak bumi, industri petrokimia, dan unit industri yang memproduksi berbagai jenis bahan kimia organik.
Efek Beracun:
VOC yang mengandung air limbah bila terus kontak dengan udara akan menyebabkan volatilisasi VOC dan dengan demikian menyebabkan polusi atmosfer. Air limbah yang mengandung VOC biodegradable jika dibuang tanpa diolah ke badan air permukaan akan menyebabkan penipisan DO pada badan penerima.
Beberapa VOC, seperti benzene, toluene, dan xylene (BTX) beracun. Benzena adalah karsinogen. Pengurangan air olahannya di bawah 500 ppb merupakan persyaratan kepatuhan. Batasan dalam air minum untuk benzena, toluena dan xilena masing-masing adalah 0,01,0,7 dan 0,5 mg/L.
Teknologi Perawatan:
Metode yang dapat digunakan untuk pengurangan VOC dari air limbah adalah:
(a) Pengupasan udara/nitrogen, dan
(b) Adsorpsi karbon aktif.
(a) Pengupasan Udara/Nitrogen:
Untuk menghilangkan VOC dari aliran air limbah dapat dihilangkan dengan aliran gas, seperti udara atau nitrogen. Uap tidak digunakan untuk pengupasan VOC dari air limbah karena diperlukan uap dalam jumlah yang sangat besar untuk memanaskan air limbah, akibatnya proses tersebut menjadi tidak ekonomis. Proses ini umumnya dilakukan dalam kolom yang dikemas. Untuk menghindari pengotoran kolom, aliran air limbah harus diolah terlebih dahulu untuk menghilangkan partikel padat tersuspensi serta polutan organik yang tidak mudah menguap.
Dalam penari telanjang, air limbah dimasukkan di bagian atas dan gas di bagian bawah, alirannya berlawanan arah.
Untuk merancang kolom yang sesuai, hal-hal berikut harus dipertimbangkan:
(i) laju aliran air limbah,
(ii) Tingkat penghilangan polutan yang paling ofensif yang diinginkan, dan
(iii) Temperatur pengoperasian.
Karena konsentrasi polutan dalam banyak kasus akan rendah, data kesetimbangannya dapat dinyatakan dengan hukum Henry.
Kolom harus dirancang berdasarkan polutan yang ditargetkan dan tingkat penghilangan yang diinginkan. Tingkat penghilangan VOC lain yang ada kemudian harus diperkirakan berdasarkan kolom yang dirancang. Dimensi kolom akan bergantung pada rasio gas terhadap cairan, koefisien perpindahan massa dan pengepakan (tipe dan ukuran) yang dipilih.
Rasio volumetrik gas ke cairan sekitar 50: 1 dianggap bagus. Kolom harus dirancang berdasarkan beban hidrolik dan polutan puncak dan bukan beban rata-rata.
Udara dapat dipilih sebagai gas pengupas jika tidak diinginkan untuk memperoleh kembali VOC yang dilucuti. Udara sarat VOC tidak boleh dibuang ke atmosfer untuk menghindari polusi atmosfer. Itu harus dibakar baik di boiler utilitas atau boiler limbah panas atau insinerator katalitik.
Karena beberapa polutan yang ada dalam air limbah dapat terurai secara hayati, polutan tersebut akan mengalami biodegradasi dan menghasilkan biomassa dalam stripper udara. Biomassa yang dihasilkan dapat menyebabkan pengotoran kolom. Untuk menghilangkan akumulasi biomassa, salah satu dari biosida berikut dapat digunakan: (i) biosida pengoksidasi, seperti klorin atau klorin dioksida, (ii) larutan kaustik atau asam encer. Masing-masing memiliki beberapa keterbatasan.
Nitrogen dapat digunakan untuk melucuti VOC dari air limbah dalam sistem loop tertutup jika ekonomis untuk memulihkan VOC yang dilucuti, seperti BTX.
Sistem loop tertutup akan memiliki unit berikut:
(i) Unit modifikasi RH (kelembaban relatif),
(ii) Lapisan adsorpsi karbon aktif (setidaknya dua, dioperasikan bergantian), dan
(iii) Blower resirkulasi nitrogen.
Unit modifikasi RH sangat penting karena pada RH 50% atau lebih, adsorpsi VOC oleh lapisan karbon akan menjadi tidak efisien.
Proses tersebut dilakukan melalui langkah-langkah berikut:
(i) VOC dipisahkan dari air limbah yang diolah sebelumnya dengan gas nitrogen dalam kolom yang dikemas,
(ii) Gas nitrogen sarat VOC yang meninggalkan stripper dapat dipanaskan hingga 10-15 °C di atas titik embunnya atau terlebih dahulu didinginkan dan dikondensasikan beberapa uap air dan kemudian dipanaskan kembali hingga 10-15 °C di atas titik embunnya,
(iii) Aliran gas termodifikasi RH selanjutnya dilewatkan melalui satu atau dua unggun adsorpsi karbon dimana sebagian besar VOC akan terserap; dan
(iv) Akhirnya, aliran nitrogen yang muncul dari absorber didaur ulang kembali ke stripper. Aliran nitrogen daur ulang akan selalu mengandung beberapa VOC dengan berat molekul rendah. Untuk menghindari penumpukannya, sebagian dari gas daur ulang dibersihkan dari waktu ke waktu dan yang hilang diganti dengan nitrogen segar.
Saat dan ketika lapisan karbon mencapai titik putusnya, lapisan tersebut dilepas dan dibuat ulang dengan pengupasan uap. Campuran uap-VOC dikondensasikan untuk pemulihan VOC.
(b) Adsorpsi Karbon Aktif:
Senyawa organik yang ada dalam air limbah sebagai zat terlarut serta tetesan dapat dihilangkan dengan karbon aktif dapat digunakan. Dari sudut pandang regenerasi dan penggunaan kembali karbon bubuk bukanlah pilihan yang baik. Adsorben yang paling efektif adalah karbon aktif granular (GAC). Keunikannya terletak pada luas permukaan spesifiknya yang tinggi dan jaringan porinya terdiri dari mikro, maso dan makrospora.
Ini memiliki daya serap yang tinggi. Salah satu kelemahan utama GAC adalah adsorpsi zat organik yang tidak selektif. Itu dibuat ulang dan digunakan kembali. Regenerasi GAC berarti desorpsi VOC yang teradsorpsi. VOC dengan berat molekul rendah mudah didesorbsi, sedangkan zat organik dengan berat molekul tinggi, seperti minyak, gemuk, tar, dll., tidak dapat diserap dengan baik.
Penghapusan VOC oleh proses adsorpsi karbon adalah salah satu siklus. Ini terdiri dari melewatkan aliran air limbah (mengandung zat organik terlarut dan tersuspensi) melalui kolom yang dikemas dengan GAC. Zat organik terserap pada permukaan butiran karbon.
Proses berlanjut hingga luas permukaan semua partikel (termasuk luas porinya) hampir seluruhnya tertutup oleh molekul yang teradsorpsi. Kondisi ini disebut sebagai “break point”. Jika kolom dioperasikan di luar titik ini, kandungan VOC dari aliran efluen akan hampir sama dengan influen. Pada tahap ini partikel karbon harus diregenerasi, yaitu zat yang diserap harus dihilangkan, jika akan digunakan kembali.
Regenerasi:
Langkah pertama dalam regenerasi adalah mengalirkan air yang tertahan dari kolom.
Butiran karbon kemudian dapat diregenerasi menggunakan salah satu dari metode berikut:
(i) Pengupasan udara/uap di tempat,
(ii) Pemanasan partikel di luar lokasi dengan pasokan udara terbatas.
Pengupasan udara/uap di tempat akan lebih murah. Namun, itu tidak dapat menghilangkan sebagian besar VOC dengan berat molekul tinggi. Saat pengupasan dengan udara, kehati-hatian harus dilakukan agar campuran udara-VOC harus selalu berada di bawah batas ledak bawahnya (LEL). Sangat sulit, jika bukan tidak mungkin, untuk menghilangkan semua zat yang terserap.
Residu yang tertinggal pada partikel karbon setelah pengupasan disebut sebagai “tumit”. Tumit mengurangi kapasitas adsorpsi dari tempat tidur yang diregenerasi. Tumit akan lebih rendah jika pengupasan dilakukan dengan uap pada suhu yang lebih tinggi.
Desorpsi VOC di luar lokasi lebih mahal. Ketika senyawa organik dengan berat molekul tinggi, seperti minyak, lemak, dll. Diadsorpsi dari air limbah, senyawa tersebut tidak dapat didesorpsi oleh pengupasan udara/uap. Mereka terus menumpuk pada butiran karbon (sebagai tumit). Akibatnya kapasitas kerja (adsorpsi) kolom akan semakin menurun.
Untuk meregenerasi partikel karbon yang dikeluarkan dari kolom dan dipanaskan di dalam ruangan dengan pasokan udara yang terbatas. Ini akan menghasilkan tidak hanya penghilangan (oksidasi) zat yang diserap tetapi juga oksidasi beberapa bagian partikel karbon.
Untuk mengatasi situasi ini ‘guard column’ dapat dipasang sebelum ‘main adsorber’. Kolom pelindung akan menjebak polutan dengan berat molekul tinggi sedangkan penyerap utama akan menghilangkan VOC yang lebih ringan dari aliran air limbah. Penyerap utama dapat diregenerasi dengan pengupasan udara/uap dan partikel karbon kolom pelindung dapat diregenerasi dengan oksidasi udara atau diganti dari waktu ke waktu. Selama regenerasi kolom harus diisolasi. Oleh karena itu, untuk operasi berkelanjutan dari sistem seperti itu, penting untuk memiliki setidaknya dua kolom adsorpsi yang beroperasi secara bergantian.
Pestisida:
Insektisida, herbisida dan fungisida umumnya disebut sebagai pestisida. Ini mungkin bahan kimia anorganik atau organik. Ini berbahaya bagi manusia, hewan peliharaan serta flora dan fauna yang berguna. Namun, penggunaannya tidak dapat dihindari karena manusia mampu mengurangi kerugian pertanian dan hortikultura sampai batas tertentu dengan menggunakan pestisida.
Sumber:
Air limbah yang berasal dari unit pembuatan pestisida akan mengandung mereka bersama dengan beberapa polutan organik lainnya. Air limpasan dari ladang pertanian dan kebun buah-buahan di mana pestisida digunakan akan selalu mengandungnya. Air limpasan mencemari tidak hanya badan air permukaan tetapi juga air tanah. Air minum yang dihasilkan oleh pengolahan air konvensional dari sumber yang terkontaminasi pestisida tersebut akan berbahaya.
Efek Beracun:
Menelan pestisida dalam jumlah besar menyebabkan efek kesehatan yang sangat merugikan. Jumlah kecil yang tertelan dapat menumpuk di dalam tubuh dan dapat mempengaruhi sistem saraf pusat dalam jangka panjang. Pestisida yang berbeda mempengaruhi organ tubuh manusia yang berbeda, misalnya hati, sistem reproduksi, dll.
Pestisida organ fosfor dan karbonat sangat beracun. Herbisida, secara umum, kurang beracun dibandingkan insektisida. Pestisida seharusnya tidak ada dalam air minum, namun jika tidak ada sumber alternatif, batas yang diperbolehkan adalah 0,001 mg/L.
Teknologi Perawatan:
Pestisida anorganik dan pestisida organologam dapat ditangani dengan salah satu atau kombinasi metode berikut:
(i) Oksidasi,
(ii) Pengurangan,
(iii) Curah hujan, dan
(iv) Pemisahan membran (RO).
Perlu dicatat bahwa RO tidak mengubah pestisida yang ada dalam air limbah menjadi zat yang tidak berbahaya tetapi menghasilkan aliran yang pekat, yang harus diolah lebih lanjut untuk mengubah pestisida menjadi zat yang tidak berbahaya.
Metode yang tersedia untuk pengurangan pestisida organik dari air limbah adalah (i) adsorpsi karbon aktif, (ii) reverse osmosis (RO), dan (iii) oksidasi kimia.
(i) Adsorpsi karbon aktif dapat dilakukan dengan GAC (granulated active carbon). Partikel bekas harus diregenerasi dengan oksidasi udara untuk menghancurkan adsorbat.
(ii) Reverse osmosis akan menghasilkan aliran yang kaya akan pestisida, yang membutuhkan oksidasi kimia untuk penghancuran pestisida.
(iii) Oksidasi kimia pestisida yang terdapat dalam air limbah dapat dilakukan dengan oksidan yang sesuai dengan adanya katalis. Kelayakan ekonomi dari proses ini akan bergantung pada jumlah air limbah yang akan diolah dan konsentrasi awal polutan yang ada.



