Sebelum menyimak Soal dan pembahasan asam basa jenjang SMA dalam bentuk pilihan ganda ada baiknya menyimak penjelasan singkat tentang kedua jenis larutan kimia ini. Asam dan basa adalah dua jenis khusus dari bahan kimia. Hampir semua cairan akan tergolong sebagai asam atau basa sampai beberapa derajat. Apakah cairan adalah asam atau basa tergantung pada jenis ion di dalamnya. Jika memiliki banyak ion hidrogen, maka itu adalah asam. Jika memiliki banyak ion hidroksida, maka itu adalah basa.
Para ilmuwan menggunakan sesuatu yang disebut skala pH untuk mengukur seberapa besar asam atau basa cairan. pH adalah angka dari 0 sampai 14. Dari 0-7 adalah asam, dengan 0 menjadi yang terkuat. Dari 7 sampai 14 adalah basa dengan 14 menjadi basa terkuat. Jika cairan memiliki pH 7, itu netral. Ini akan menjadi sesuatu seperti air suling.
1. Dari 1 gram NaOH (Mr = 40) akan dihasilkan larutan 0,25 M sebanyak ….
- 50 ml
- 100 ml
- 125 ml
- 150 ml
- 200 ml

2. Suatu asam lemah HA dengan konsentrasi 0,1 terionisasi sebanyak 1%. Tetapan kesetimbangan asam lemah tersebut adalah ….
- 2,5 × 10–7
- 5,0 × 10–7
- 1,0 × 10–6
- 1,0 × 10–5
- 2,5 × 10–5

3. Untuk mengubah 40 ml larutan H2SO4 6 M menjadi H2SO4 5 M diperlukan tambahan air sebanyak ….
- 4 ml
- 6 ml
- 7 ml
- 8 ml
- 9 ml

4. Diantara garam berikut ini yang akan mengalami hidrolisis sempurna jika dilarutkan dalam air adalah ….
- NaCN
- NH4CN
- (NH4)2SO4
- BaSO4
- KCl
Jawaban: B
Yang mengalami hidrolisis sempurna adalah garam dari asam lemah dan basa lemah.
- NaCN → hidrolisis sebagian karena merupakan garam dari basa kuat dan asam lemah.
- NH4CN→hidrolisis sempurna karena merupakan garam dari basa lemah dan asam lemah.
- (NH4)2SO4→hidrolisis sebagian karena merupakan garam dari basa lemah dan asam kuat.
- BaSO4 → tidak terhidrolisis karena merupakan garam dari basa kuat dan asam kuat.
- KCl → tidak terhidrolisis karena merupakan garam dari basa kuat dan asam kuat.
5. Bila 0,1 gram NaOH dilarutkan menjadi 250 ml, maka pH larutan adalah ….
- 1
- 2
- 13
- 12
- 7
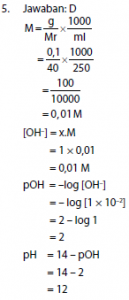
6. Asam konjugasi dari basa H2PO4– ….
- H3PO4
- H2PO4
- HPO4–2
- PO4–2
- H3O+

7. Pada pelarutan NH3 terjadi kesetimbangan sebagai berikut.
NH3(aq) + H2O(l) ↔ NH4+ (aq) + OH– (aq)
Yang merupakan pasangan asam-basa konjugasi adalah ….
- NH3 dan H2O
- NH4+ dan OH–
- NH3 dan OH–
- H2O dan NH4+
- H2O dan OH–
Jawaban: E
Menurut Bronsted Lowry:
Asam → Pemberi proton
Basa → Penerima proton
Maka asam basa konjugasi adalah H2O dan OH–.
8. Senyawa HClO4 dapat bersifat asam maupun basa. Reaksi yang menunjukkan bahwa HClO4 basa adalah ….
- HClO4 + NH2– ↔ ClO4– + NH3
- HClO4 + NH3 ↔ ClO4– + NH4+
- HClO4 + H2O ↔ ClO4– + H3O+
- HClO4 + OH– ↔ ClO4– + H2O
- HClO4 + N2H5+ ↔ H2ClO4– + N2H4
Jawaban: E
HCLO4 bersifat basa jika menerima H+ menjadi H2ClO4+
9. Diantara oksida berikut yang dalam air dapat membirukan kertas lakmus adalah ….
- CO2
- SO2
- NO2
- CaO
- P2O5
Jawaban: D
Lakmus merah berubah menjadi lakmus biru jika dalam larutan basa. Oksida yang bersifat basa jka dilarutkan dalam air adalah oksida logam (= oksida basa), yaitu oksida dari unsur logam.
10. Berikut ini adalah hasil uji sifat asam/basa dari beberapa garam:
| Larutan | Rumus garam | Uji lakmus | |
| Merah | biru | ||
| 1 | NaCl | Merah | Biru |
| 2 | CH3COOK | Biru | Biru |
| 3 | NH4Cl | Merah | Merah |
| 4 | Na2SO4 | Biru | Biru |
| 5 | NaCN | Biru | Biru |
Garam yang mengalami hidrolisis dan sesuai dengan hasil uji lakmusnya adalah ….
- 1, 2 dan 3
- 1, 2 dan 4
- 2, 3 dan 4
- 2, 3 dan 5
- 3, 4 dan 5
Jawaban: D
Garam-garam yang mengalami hidrolisis berasal dari:
- asam lemah + basa kuat
- asam kuat + basa lemah
- asam lemah + basa lemah
Maka pernyataan yang benar adalah nomor 2, 3, dan 5.
11. Satu liter larutan yang mengandung 0,1 mol NH3 (Kb = 10–5) dan 0,05 mol (NH4)2SO4 mempunyai pH yaitu ….
- 5
- 5 – log 2
- 9
- 9 – log 2
- 9 + log 2
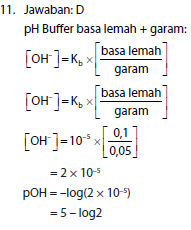
pH = 14 – (5 – log2)
= 9 – log2
12. Berdasarkan reaksi ionisasi Ag2CO3, maka rumus Ksp Ag2CO3 yang tepat adalah ….
- [Ag+] [CO32–]
- [Ag+]2 [CO32–]
- [Ag2+] [CO3–]
- [Ag+] [CO32–]2
- [Ag+]2 [CO32–]2
Jawaban: B
Reaksi ionisasi Ag2CO3:
Ag2CO3 ↔ 2Ag+ + CO32–
Ksp = [Ag+]2 [CO32–]
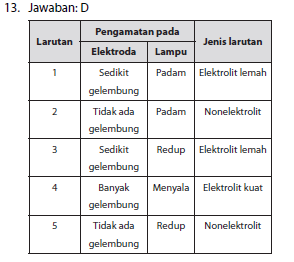
13. Perhatikan data percobaan uji larutan berikut:
| Larutan | Pengamatan pada | |
| Elektroda | Lampu | |
| 1 | Sedikit gelembung | Padam |
| 2 | Tidak ada gelembung | Padam |
| 3 | Sedikit gelembung | Redup |
| 4 | Banyak gelembung | Menyala |
| 5 | Tidak ada gelembung | Redup |
Pasangan senyawa yang merupakan larutan elektrolit kuat dan elektrolit lemah berturut-turut adalah larutan nomor ….
- 1 dan 4
- 2 dan 3
- 2 dan 4
- 4 dan 3
- 5 dan 4
14. Dicampurkan sejumlah HNO2 dengan larutan NaOH membentuk larutan penyangga. Setelah reaksi terdapat 0,02 mol NaNO2, dan 0,47 gram HNO2. pH larutan penyangga tersebut adalah …. (Ka HNO2 = 4 × 10-4 Mr HNO2 = 47)
- 4 – log 2
- 4 – log 4
- 4 – log 8
- 8 + log 2
- 8 + log 2

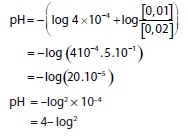
15. Jika Ksp Ag2CO3 = 1 × 10–14, maka kelarutan Ag2CO3 dalam AgCl 0,1 M adalah ….
- 5 × 10–13 mol/l
- 1 × 10–12 mol/l
- 2 × 10–12 mol/l
- 5 × 10–9 mol/l
- 1 × 10–8 mol/l


sangat membantu