Bagaimana penyelam tahu kapan mereka akan kehabisan gas (simak ilustrasi di bawah)? Mengetahui berapa banyak gas yang tersedia untuk menyelam sangat penting untuk kelangsungan hidup penyelam. Tangki di punggung penyelam dilengkapi dengan alat pengukur untuk memberitahu berapa banyak gas yang terdapat dan berapa besar tekanannya.
Sebuah pengetahuan dasar tentang perilaku gas memungkinkan penyelam untuk menilai berapa lama tinggal di bawah air tanpa mendapat masalah.
Hipotesis Avogadro dan Volume Molar
Volume adalah cara ketiga untuk mengukur jumlah materi, setelah menghitung konten dan massa. Dalam wujud cairan dan padatan, volume akan bervariasi tergantung pada kepadatan zat. Hal ini karena partikel padat dan cair yang dikemas dekat bersama-sama dengan sangat sedikit ruang di antara partikel. Namun, gas yang sebagian besar terdiri dari ruang kosong antara partikel gas yang sebenarnya (lihat Gambar di bawah).
Pada tahun 1811, Amedeo Avogadro menjelaskan bahwa volume semua gas dapat dengan mudah ditentukan. Hipotesis Avogadro menyatakan bahwa volume yang sama dari semua gas pada suhu dan tekanan yang sama mengandung jumlah yang sama dari partikel. Karena total volume yang menempati gas terdiri terutama dari ruang kosong antara partikel, ukuran sebenarnya dari partikel sendiri hampir diabaikan. Volume tertentu dari gas dengan partikel kecil seperti hidrogen (H 2) mengandung jumlah yang sama dari partikel dengan volume yang sama dari berat gas dengan partikel besar seperti belerang heksafluorida, SF6.

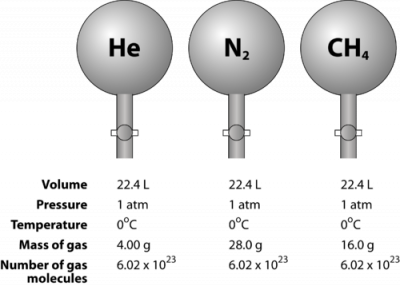
Gas adalah zat yang kompresibel, yang berarti bahwa ketika diletakkan di bawah tekanan tinggi, partikel dipaksa lebih dekat satu sama lain. Hal ini mengurangi jumlah ruang kosong dan mengurangi volume gas. Volume gas juga dipengaruhi oleh suhu. Ketika gas dipanaskan, molekul-molekulnya bergerak lebih cepat dan gas mengembang. Karena variasi volume gas karena tekanan dan perubahan suhu, perbandingan volume gas harus dilakukan pada satu suhu dan tekanan standar. Temperatur dan tekanan standar (STP) didefinisikan sebagai 0 ° C (273,15 K) dan tekanan 1 atm. Volume molar gas adalah volume satu mol gas pada STP. Pada keadaan STP, satu mol (6,02 × 10 23 partikel) gas menempati volume 22,4 L (Gambar di bawah).

Gambar di bawah ini menggambarkan bagaimana molar volume yang dapat dilihat ketika membandingkan gas yang berbeda. Sampel helium (He), nitrogen (N 2), dan metana (CH 4) berada pada STP. Masing-masing berisi 1 mol atau 6,02 × 10 23 partikel. Namun, massa masing-masing gas berbeda dan sesuai dengan massa molar gas dengan: 4.00 g / mol untuk He, 28,0 g / mol untuk N 2, dan 16,0 g / mol untuk CH 4.
Ringkasan
Volume gas yang sama pada kondisi yang sama mengandung jumlah partikel yang sama.

TERIMA KASIH MEMBANTU SAYA……………………………..