Proses kontak adalah metode untuk produksi industri asam sulfat. Proses kontak adalah standar industri untuk produksi bahan kimia ini dalam pemurnian dan volume yang dibutuhkan untuk pembuatan aplikasi mulai dari baterai sampai produksi pupuk. Penggunaan Proses kontak sejak pertengahan 1800-an, ketika ahli kimia Inggris pertama kali dikembangkan untuk memenuhi kebutuhan pertumbuhan revolusi industri. Setelah produksi di pabrik kimia, asam sulfat siap untuk pengiriman ke produsen dan fasilitas lainnya.
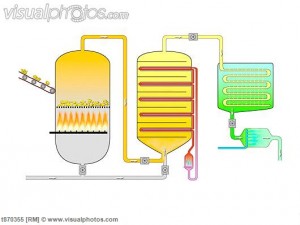
Ada empat tahap dalam produksi asam sulfat dengan proses kontak. Yang pertama melibatkan produksi sulfur dioksida, seringkali dengan membakar di lingkungan tinggi oksigen. Pada langkah kedua, lebih banyak oksigen ditambahkan bersama dengan vanadium oksida, yang bertindak sebagai katalis untuk membuat sulfur trioksida pada langkah berikutnya. Hal ini menciptakan senyawa yang dikenal sebagai oleum yang dapat dicampur dengan air untuk membuat asam sulfat di langkah terakhir.
Perusahaan dapat menggunakan proses ini untuk menghasilkan volume yang sangat besar asam sulfat. Teknisi secara ketat mengontrol kondisi untuk menjaga bahan kimia semurni mungkin. Kontaminasi dapat mempengaruhi proses kontak atau membuat masalah dengan bahan kimia setelah selesai. Untuk tujuan kontrol kualitas, perusahaan dapat secara periodik mengambil sampel dari batch asam sulfat dan menguji mereka untuk mengkonfirmasi mereka bebas dari kontaminan dan siap untuk digunakan. Fasilitas dapat membuat campuran bahan kimia dan penting untuk menjaga mereka semua pada keadaan tinggi kemurnian.
Bahan kimia ini bisa berbahaya. Teknisi perlu waspada selama proses kontak dan paket asam sulfat harus selesai dengan hati-hati untuk menghindari cedera. Mereka menggunakan wadah reaktif untuk membatasi risiko masalah selama pemrosesan dan pengiriman, dan untuk memastikan bahwa bahan kimia tersebut akan tiba utuh pada tujuan akhir. Untuk pengiriman yang sangat besar, perusahaan dapat mengisi truk tangki atau mobil kereta api dan menggunakan ini untuk pengangkutan asam sulfat jadi mereka.
Dasar-dasar proses kontak tetap konsisten, tetapi masing-masing pabrik dapat men-tweak sedikit proses. Hal ini dimungkinkan untuk menggunakan katalis yang berbeda, dan ada beberapa cara untuk menghasilkan sulfur dioksida pertama. Perusahaan juga perlu mempertimbangkan isu-isu seperti potensi pencemaran. Tumpah bahan kimia selama proses ini dapat mengakibatkan pembayaran denda atau biaya pembersihan, atau paparan tuntutan hukum dari anggota masyarakat yang terluka oleh bahan kimia. Tindakan seperti penyaringan air limbah dan kontrol ketat dari fasilitas manufaktur membantu membatasi polusi dan menjaga masyarakat sekitar aman.
Proses
Prosesnya dapat dibagi menjadi lima tahap:
- Menggabungkan sulfur dan oksigen (O2) untuk membentuk sulfur dioksida
- Memurnikan belerang dioksida dalam unit pemurnian
- Menambahkan kelebihan oksigen ke sulfur dioksida dengan adanya katalis vanadium pentoksida pada 450 ° C dan 1-2 atm
- Sulfur trioksida yang terbentuk ditambahkan ke asam sulfat yang menimbulkan oleum (asam disulfurat)
- Oleum kemudian ditambahkan ke air untuk membentuk asam sulfat yang sangat pekat.
- Pemurnian udara dan sulfur dioksida (SO2) diperlukan untuk menghindari keracunan katalis (yaitu menghilangkan aktivitas katalitik). Gas tersebut kemudian dicuci dengan air dan dikeringkan dengan asam sulfat.
Untuk menghemat energi, campuran dipanaskan oleh gas buang dari catalytic converter oleh penukar panas.
Belerang dioksida dan dioksigen kemudian bereaksi sebagai berikut:
2 SO2(g) + O2(g) ⇌ 2 SO3(g) : ΔH = -197 kJ·mol−1
Menurut prinsip Le Chatelier, suhu yang lebih rendah harus digunakan untuk menggeser kesetimbangan kimia ke kanan, sehingga meningkatkan persentase hasil. Namun suhu yang terlalu rendah akan menurunkan laju pembentukan ke tingkat yang tidak ekonomis. Karenanya untuk meningkatkan laju reaksi, suhu tinggi (450 ° C), tekanan sedang (1-2 atm), dan vanadium (V) oksida (V2O5) digunakan untuk memastikan konversi yang memadai (> 95%). Katalis hanya berfungsi untuk meningkatkan laju reaksi karena tidak mengubah posisi kesetimbangan termodinamika. Mekanisme kerja katalis terdiri dari dua langkah:
Oksidasi SO2 menjadi SO3 oleh V5 +:
2SO2 + 4V5+ + 2O2− → 2SO3 + 4V4+
Oksidasi V4 + kembali menjadi V5 + oleh dioksigen (regenerasi katalis):
4V4+ + O2 → 4V5+ + 2O2−
Sulfur trioksida panas melewati penukar panas dan dilarutkan dalam H2SO4 pekat dalam menara serapan untuk membentuk oleum:
H2SO4 (l) + SO3 (g) → H2S2O7 (l)
Perhatikan bahwa melarutkan SO3 dalam air secara langsung tidak praktis karena sifat reaksi yang sangat eksotermik. Uap atau kabut asam terbentuk alih-alih cairan.
Oleum direaksikan dengan air untuk membentuk H2SO4 pekat.
H2S2O7 (l) + H2O (l) → 2 H2SO4 (l)