Titik didih dan titik beku dari suatu zat cair merupakan salah satu ciri dari kemurnian zat cair itu. titik didih zat cair didefinisikan sebagai,
suhu di mana tekanan uap zat cair itu sama dengan tekanan udara sekitar.
Titik didih yang diukur pada tekanan udara 760 mmHg disebut titik didih normal. Titik didih air pada tekanan 760mmHg adalah 100°C. Tabel. Titik Didih Air pada Berbagai Tekanan
| Titik Didih (0C) | 97,71 | 98,11 | 98,49 | 98,88 | 99,26 | 99,63 | 100 | 100,4 |
| Tekanan Udara (mmHg) | 700 | 710 | 720 | 730 | 740 | 750 | 760 | 770 |
Sedangkan titik beku (atau titik leleh) didefinisikan sebagai
Suhu di mana suatu zat dengan fasa cair dan fasa padatnya berada dalam kesetimbangan.
Dengan adanya zat terlarut menyebabkan tekanan uap pelarut murni turun atau tekanan uap larutannya akan lebih rendah dari tekanan uap pelarut murninya. Dengan demikian adanya zat terlarut, titik didih larutan tidak akan sama dengan titik didih pelarut murninya.
Cairan baru mendidih bila tekanan uapnya sama dengan tekanan udara sekitar. Pelarut air mendidih pada 100°C pada tekanan uap air 760 mmHg.
Tetapi larutannya, pada 100°C belum mendidih karena tekanan uapnya kurang dari 760 mmHg. Larutan akan mendidih pada suhu yang lebih tinggi agar tekanan ini mencapai 760 mmHg.
Dengan demikian, adanya zat terlarut akan mengakibatkan kenaikan titik didih larutannya. Perbedaan ini dapat digambarkan menurut diagram fasa berikut ini.
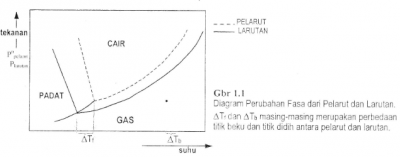
Setiap zat terlarut dalam pelarut yang memberikan 1 molal partikel dalam larutannya akan menyebabkan kenaikan titik didih yang sama besar. Besarnya kenaikan titik didih per 1 molal larutan dikenal sebagai kenaikan titik didih molal (simbol: Kb), dan untuk setiap pelarut memiliki harga Kb tertentu (lihat Tabel).
Tabel. Titik Didih, Tb (pada 1 atm) dan Harga Kb, Beberapa Pelarut
| Pelarut | Tb (0C) | Kb (0C/molal) |
| Air, H2O | 100,0 | 0,52 |
| Etanol, C2H2OH | 78,4 | 1,22 |
| Benzena, C6H6 | 80,1 | 2,53 |
| Kloroform, CHCl3 | 64,2 | 3,63 |
| Karbontetraklorida,CCl4 | 76,8 | 5,03 |
Pelarut air memiliki Kb sebesar 0,52; berarti tiap 1 mol zat terlarut di dalam 1000 g pelarut air akan menyebabkan kenaikan titik didih sebesar 0,52°C; atau larutannya akan mendidih pada suhu 100,520C. Hubungan antara banyaknya zat terlarut dan kenaikan titik didih larutannya adalah:
ΔTb = m.Kb
Dimana: ΔTb kenaikan titik didih; m = molalitas zat terlarut, dan Kd = tetapan titik didih molal
Persamaannya dapat dinyatakan ke dalam bentuk;
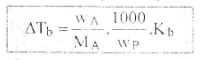
Dimana; WA = massa zat terlarut A; WP = massa pelarut P, dan MA = Mr zat terlarut A.
