Bacalah artikel ini untuk mempelajari tentang proses pengurangan senyawa nitrogen: 1. Pengurangan Senyawa Basa dan 2. Pengurangan Senyawa Asam.
Pengurangan Senyawa Dasar:
Sumber:
Beberapa operasi industri dan proses manufaktur menyebabkan emisi senyawa nitrogen dasar, seperti amonia, amina, piridin, dll. Sumber utamanya adalah industri sintesis amonia dan pupuk nitrogen, unit karbonisasi batubara, unit produksi amina, dan proses yang menggunakan amina.
Proses Pengurangan:
Senyawa yang disebutkan di atas bersifat basa dan sangat reaktif. Ini dapat dengan mudah dikurangi dari limbah gas dengan menggosok dengan air atau dengan larutan asam sulfat encer.
Pengurangan Senyawa Asam / Oksida:
Sumber:
Asam nitrat (HNO 2 ) dan asam nitrat (HNO 3 ) dipancarkan dari unit pembuatan / pemekatan asam nitrat dan unit nitrasi. Seiring dengan uap asam ini, oksida nitrogen (biasanya disebut NO x ) selalu dipancarkan.
Sumber utama emisi NOx adalah pembakar bergerak maupun stasioner yang digunakan untuk pembakaran bahan bakar fosil dan turunannya. Sumber emisi NOx lainnya adalah pengawetan asam nitrat dan operasi anodisasi.
Oksida nitrogen yang stabil adalah oksida nitrat (NO), nitrogen dioksida (NO 2 ), nitrogen seskuioksida (N 2 O 3 ), nitrogen tetraoksida (N 2 O A ), dan nitrogen pentoksida (N 2 O 5 ). Ini adalah gas beracun dan korosif. Di troposfer mereka membentuk asam nitrat dan nitrat dan juga mengambil bagian dalam reaksi fotokimia.
Proses Pengurangan: Penghapusan Uap Asam
Pengurangan uap asam nitrat/nitrat dari aliran gas limbah dapat dilakukan dengan menggosok dengan air atau dengan larutan alkali. Pilihan penyerap akan bergantung pada apakah itu proses pemulihan atau proses pembuangan.
Proses Pengurangan: NO x Penghapusan:
- Penyerapan dalam Air:
Penghapusan NO x dengan penyerapan dalam air agak sia-sia. NO 2 , bereaksi dengan air menghasilkan HNO 2 dan HNO 3 . HNO 2 pada gilirannya menghasilkan NO. NO dengan demikian tidak larut dalam air atau larutan alkali. NO bereaksi dengan O 2 (di udara) dan menghasilkan NO 2 .
Proses ini lambat. Reaksi yang terjadi selama penyerapan adalah:
2NO 2 + H 2 O ——-> HNO 2 + HNO 3 ……………….(5.64)
3 HNO 2 ——->2 NO + HNO 3 + H 2 O ……………….(5.65)
2 NO + O 2 ——->2NO 2 ……………….(5.66)
Efisiensi penyisihan NOx dengan penyerapan dalam air agak rendah, sekitar 30-50%.
- Penyerapan dalam Larutan Alkali:
Pengurangan NO x dari limbah gas dengan menggosok dengan larutan berair dari berbagai zat alkali, seperti natrium hidroksida, natrium karbonat, kalsium hidroksida, amonium karbonat, bikarbonat, sulfit dan bi-sulfit telah dicoba. Penggosokan alkali dapat menghasilkan efisiensi penyisihan sekitar 90%. Namun, penghilangan NO x dari gas buang dengan scrubbing alkali tidak ekonomis karena adanya CO 2 dalam gas buang. CO 2 akan bereaksi dengan alkali, maka konsumsi bahan kimia akan tinggi.
- Dekomposisi Katalitik NO x
Katalis, seperti platinum, paduan platinum-rhodium, oksida tembaga pada gel silika dan berbagai oksida lainnya telah dicoba untuk dekomposisi NO x . Tidak ada yang memuaskan, terutama untuk dekomposisi NO.
- Katalitik Reduksi NO x
Reduksi NO 2 menjadi NO lebih mudah menggunakan bahan bakar seperti gas alam, gas oven kokas, CO, H 2 , uap minyak tanah, dll., dengan katalis platina atau paladium. Katalis ini mahal. Selain itu, konsumsi bahan bakar tinggi dan proses menjadi tidak ekonomis ketika penghilangan NOx dicoba dari limbah gas (seperti gas buang) yang mengandung oksigen dalam proporsi yang relatif besar, karena semua oksigen akan bereaksi dengan bahan bakar yang digunakan sebelum reduksi. dari NO dimulai.
- Reduksi Katalitik Selektif NOx (SCR):
Reduksi katalitik NOx dengan amonia ternyata cukup efektif bahkan untuk pengolahan gas buang. Katalis yang digunakan adalah Vanadia (V 2 O 5 ) dengan basis Titania (TiO 2 ). Vanadia mempromosikan oksidasi SO 2 (hadir dalam gas buang) menjadi SO 3 , yang bergabung dengan amonia menghasilkan kebutuhan amonia yang lebih tinggi. Ketika Tungsten oksida digunakan sebagai konstituen katalis, ini mengurangi konsentrasi oksigen pada permukaan katalis dan dengan demikian menghambat oksidasi SO2.
SO 2 menguntungkan di atas 370°C. Proses SRC dapat dengan mudah dilakukan di atas 315 °C dimana aktivitas amonia (untuk reduksi NOx) tinggi dan pembentukan garam amonium (sulfat) terhambat. Untuk proses ini baik amonia anhidrat atau amonia berair (mengandung 20 sampai 30% NH 3 ) dapat digunakan. Efisiensi penghilangan NO x mungkin setinggi 95%. Reaksi (tercantum di bawah ini) selama SCR sangat efisien, dengan stoikiometri reagen sekitar 1,0 (mol NH 3 per mol NO x tereduksi).
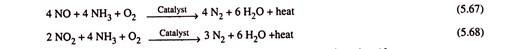
Slip amonia (keluar dari amonia yang tidak bereaksi) dapat berkisar dari 2 hingga 10 ppm.
Reduksi NOx Non-Katalitik :
NO x dapat dicapai tanpa katalis apapun dengan menginjeksikan amoniak atau urea ke area tungku dimana suhu gas buang berkisar antara 830-1200 °C. Efisiensi penyisihan NOx dapat berkisar antara 70-80% pada kondisi optimum (waktu reaksi yang memadai, pencampuran yang baik antara reagen—gas buang dan suhu yang lebih rendah) .
Suhu area injeksi yang melebihi sekitar 930 °C menghasilkan produksi N 2 dari dekomposisi reagen dan pada suhu yang lebih tinggi dari 1200 °C reagen teroksidasi menjadi NO x . Slip amonia mungkin sekitar 10-50 ppm. Beberapa reaksi yang tidak diinginkan seperti oksidasi NH 3 menjadi NO dan NO 2 dan pembentukan (NH 4 ) 2 SO 4 juga akan terjadi.
- Metode Biologis untuk NO x Penghapusan:
Metode ini dikembangkan oleh Monsanto Enviro-Chem. Sistem dan Sistem UOP dilakukan dalam dua langkah. Pada langkah pertama, gas pembawa NO x digosok dengan larutan kelat besi [Fe (EDTA)] encer. NO 2 larut dalam air dan NO membentuk kompleks nitrosil yang larut dalam air dengan kelat besi.
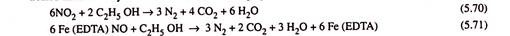
NO + Fe (EDTA) ——> Fe (EDTA) NO (5.69)
Pada langkah kedua larutan yang mengandung NO2 terlarut dan kompleks nitrosil besi EDTA diperlakukan secara anaerobik dengan etanol sebagai zat pereduksi.
Reaksi keseluruhannya adalah:
6NO 2 + 2 C 2 H 5 OH ——>3 N 2 + 4 CO 2 + 6 H 2 O ……………….(5.70)
6 Fe (EDTA) NO + C 2 H 5 OH ——>3 N 2 + 2 CO 2 + 3 H 2 O + 6 Fe (EDTA) ……………†¦.(5.71)
NO x lebih dari 80% telah dilaporkan.
- Pengendalian NO x Produksi:
Telah diketahui dengan baik bahwa proses pembakaran merupakan sumber utama emisi NOx . Oleh karena itu banyak perhatian telah diberikan untuk mengembangkan strategi dimana produksi NOx selama pembakaran bahan bakar fosil dapat dikendalikan. Lebih sedikit produksi NOx berarti lebih sedikit NOx yang harus dikurangi dan karenanya lebih ekonomis.
Telah dipastikan bahwa selama pembakaran bahan bakar fosil, NOx dihasilkan dalam dua cara:
(i) Produksi NO x karena oksidasi N 2 di udara pada suhu tinggi (dirujuk sebagai ‘thermal NO x ‘) di zona pembakaran,
(ii) Produksi NOx karena oksidasi senyawa nitrogen yang terdapat dalam bahan bakar (disebut sebagai ‘bahan bakar NOx ‘ )
NO x yang ada dalam gas buang telah ditemukan mengandung 90-95% nitric oxide (NO) dan sisanya adalah nitrogen dioksida (NO 2 ).
Untuk mengontrol emisi NO x dari pembakar stasioner, pendekatan dua tahap sekarang diikuti:
Pada tahap pertama tujuannya adalah untuk mengurangi pembentukan NO x tanpa mengorbankan efisiensi pembakaran.
Ini dicapai dengan menggunakan beberapa atau semua langkah berikut:
(a) Dengan menggunakan pembakar NO x yang rendah dimungkinkan untuk mengurangi pembentukan NO x sebesar 10-60%. Burner NO x rendah tersedia untuk aplikasi baru maupun retrofit. Prinsip dasar NOx rendah pembakar adalah untuk mengontrol dan menyeimbangkan rasio udara-ke-bahan bakar di zona pembakaran sehingga zona suhu tinggi tidak kaya oksigen.
(b) Menggunakan pementasan udara bahan bakar kaya, yaitu, zona pembakaran oksigen rendah dibuat dimana formasi NOx berkurang . Di atas zona ini, zona kaya oksigen dipertahankan untuk menyempurnakan pembakaran CO dan VOC.
(c) Staging bahan bakar dilakukan dengan maksud untuk mengurangi suhu zona pembakaran. Di bagian bawah tungku sekitar 70-80% dari total beban panas diwujudkan dengan udara berlebih yang lebih sedikit. Di zona di atas beban panas yang tersisa direalisasikan dengan kontrol rasio udara-ke-bahan bakar dan akhirnya di zona paling atas reaksi pembakaran diselesaikan dengan memasok udara dalam jumlah yang cukup dan menyediakan ruang yang cukup.
(d) Modifikasi operasional, seperti resirkulasi gas buang ke zona pembakaran, pengurangan pemanasan ulang udara, injeksi uap atau air ke dalam zona pembakaran mengurangi pembentukan NOx dengan menurunkan suhu zona pembakaran.
Pada tahap kedua dari strategi pengendalian emisi NOx, gas buang yang mengandung NOx dikenakan proses ‘Selective Catalytic Reduction (SCR)’. Untuk mengendalikan emisi NO x dari konverter katalitik mobil sedang digunakan sekarang menjadi hari.



