Pengolahan aluminium dari bauksit berlangsung dalam dua tahap. Tahap pertama adalah pemisahan Al2O3 (Alumindo) dari bauksit. Tahap kedua adalah peleburan (reduksi) Alumina.
Pengolahan Al2O3 dari bauksit didasarkan pada sifat amfoter dari oksida aluminium itu. Pengotor utama dalam bauksit biasanya terdiri atas SiO2, Fe2O3, dan TiO2. Apabila bauksit dilarutkan dalam larutan NaOH, maka Al2O3 akan larut sedangkan pengotornya tidak. Pengotor dipisahkan dengan penyaringan. Selanjutnya, aluminium diendapkan dari filtrat dengan mengalirkan gas CO2 dan pengenceran.
Endapan Al(OH)3 disaring, dikeringkan lalu dipanaskan sehingga diperoleh Al2O3 murni (Alumindo).
2Al(OH)3(s) → Al2O3(s) + 3H2O(g)
Selanjutnya pada tahap kedua, reduksi Al2O3 dilakukan melalui elektrolisis menurut proses Hall-Heroult. Metode elektrolisis itu ditemukan secara terpisah tetapi hampir bersamaan pada tahun 1886 oleh kedua orang peneliti muda, yaitu Charles M. Hall di Amerika Serikat dan Paul Heroult di Prancis. Kita ingat bahwa Al2O3 mempunyai titik leleh yang sangat tinggi, yaitu lebih dari 2000°C. oleh karena itu elektrolisis lelehan Al2O3 murni tidak ekonomis.
Dalam proses Hall-Heroult, Al2O3 dilarutkan dalam perlahan krisolit (Na3AlF6) dalam bejana dari baja berlapis grafit yang sekaligus berfungsi sebagai katode. Dengan cara itu elektrolisis dapat dilangsungkan pada suhu 9500C. Sebagai anode digunakan batang grafit (lihat gambar di bawah). Elektrolisis menghasilkan aluminium di katode, sedangkan di anode terbentuk gas oksigen dan karbon dioksida. Sebenarnya reaksi elektrolisis ini berlangsung rumit dan belum sepenuhnya dipahami, tetapi dengan mengacu pada hasil akhirnya dapat di tuliskan sebagai berikut.
Al2O3(l) → 2Al3+(l) + 3O2-(l) Katode : Al3+(l) + 3e → Al(l) Anode : 2O2-(l) → O2(g) + 4e C(s) + 2O2-(l) → CO2(g) + 4e
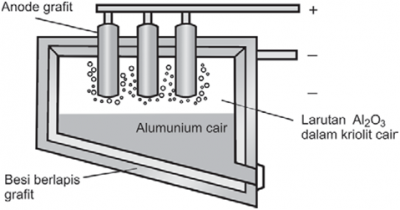
Jadi, selama elekrolisis anode terus menerus dihabiskan. Untuk memproduksi 1 kg aluminium rata-rata dihabiskan 0,44 kg anode karbon.
Aluminium memiliki banyak kegunaan dan mengenai hal itu telah dibahas dalam artikel sebelumnya. Penggunaan aluminium didasarkan pada sifatnya yang tahan karat dan massa jenisnya yang rendah (2,7 g cm-3). Aluminium tahan karat karena terbentuknya lapisan oksida pada permukaan logam yang merupakan lapisan pelindung terhadap korosi berlanjut.
Di antar penggunaan aluminium dapat disebutkan, yaitu untuk membuat badan pesawat terbang, untuk kemasan makanan (aluminium foil), untuk perkakas rumah tangga, untuk bahan bangunan, dan untuk kabel listrik. Untuk kebanyakan penggunaan aluminium tersebut, tidak digunakan aluminium murni melainkan paduannya dengan logam lain. Aluminium dan senyawa-senyawanya tidak beracun. Salah satu aluminium yaitu aluminium sulfat, Al2(SO4)3, digunakan pada pengolahan air minum. Ion Al3+ dari aluminium sulfat menggumpalkan lumpur kolosal dalam air sungai. Selain itu, ion Al3+ akan mengalami hidrolisis membentuk koloid AI(OH)3 yang akan mengadsorbsi pengotor-pengotor yang larut dalam air.
