Eksperimen untuk Membudidayakan dan Menghitung Bakteriofag!
Prinsip:
Suspensi bakteri, yang rentan terhadap bakteriofag (virus yang menginfeksi bakteri) diunggulkan dengan bakteriofag tersebut dan dibiarkan tumbuh sebagai rumput konfluen di piring agar.
Partikel bakteriofag tumbuh di dalam sel bakteri dan melisiskannya. Lisis sel bakteri menghasilkan pembentukan zona bening di halaman pertemuan bakteri. Zona bening ini disebut ‘plak’. Setiap zona bening diasumsikan dibentuk oleh satu partikel bakteriofag. Dengan demikian, jumlah unit pembentuk plak (PFU) mewakili jumlah bakteriofag.
Teknik pengenceran serial digunakan dalam pencacahan bakteriofag mirip dengan yang digunakan dalam pencacahan bakteri. Jumlah partikel fag yang terkandung dalam sampel ditentukan dengan menghitung jumlah plak yang terbentuk pada pelat agar yang diunggulkan dan mengalikannya dengan faktor pengenceran.
Untuk menentukan jumlah fag yang valid, jumlah plak per pelat tidak boleh melebihi 300 atau kurang dari 30. Pelat yang menunjukkan lebih dari 300 PFU disebut ‘terlalu banyak untuk dihitung’ (TNTC), sedangkan pelat yang menunjukkan kurang dari 30 PFU disebut ‘terlalu sedikit untuk dihitung’ (TFTC).
Bahan yang Dibutuhkan:
Kaldu tripton, agar lunak tripton, agar keras tripton, labu berbentuk kerucut, tabung reaksi, cawan petri steril, sumbat kapas, kultur stok bakteriofag (Mis: T 2 coliphage), kultur kaldu nutrisi dari bakteri (Mis: Escherichia coli B), pipet steril, autoklaf, penangas air panas, pembakar bunsen, ruang aliran laminar, tabung pembuangan, inkubator.
Prosedur:
- Lima belas pipet (dalam kotak pipet stainless steel) dan lima cawan petri disterilkan dalam oven udara panas pada suhu 180°C selama 3 jam. Alternatifnya, mereka dapat ditutup dengan kertas kerajinan, diikat dengan benang atau karet gelang dan disterilkan dalam autoklaf bersama dengan medianya (Gambar 8.3).
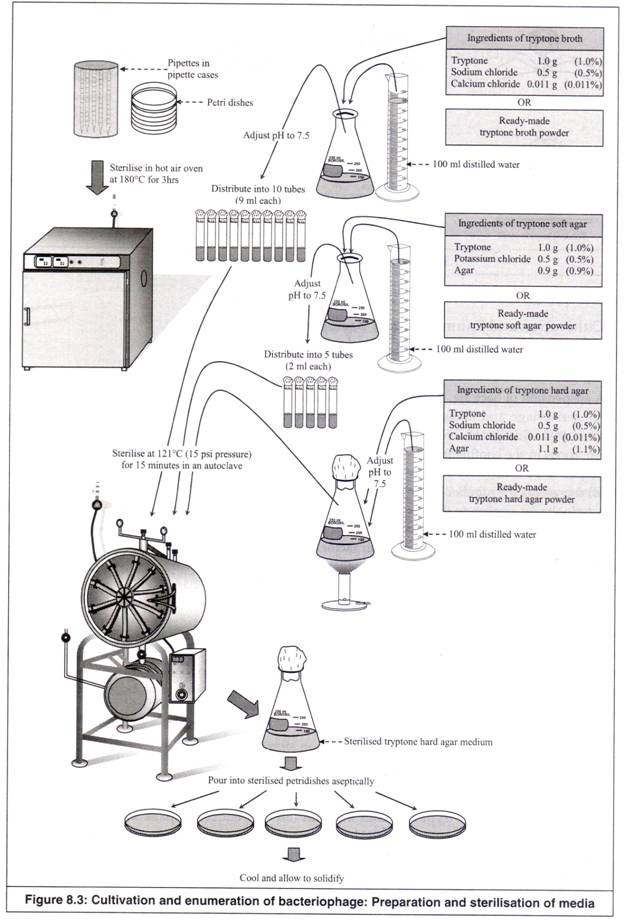
- Bahan media tryptone broth atau bubuk siap pakainya, diperlukan 100 ml kaldu ditimbang dan dilarutkan dalam 100 ml air suling dalam labu berbentuk kerucut 250 ml dengan cara dikocok dan diaduk. pH-nya disesuaikan menjadi 7,5 menggunakan 0,1N HCI atau 0,1N NaOH sesuai kebutuhan. Labu dipanaskan, jika perlu, untuk melarutkan bahan sepenuhnya.
- Kaldu disebarkan ke dalam 10 tabung reaksi (masing-masing 9 ml), ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Bahan media tryptone soft agar atau bubuk siap pakainya, diperlukan 100 ml media ditimbang dan dilarutkan dalam 100 ml air suling dalam labu berbentuk kerucut 250 ml dengan cara dikocok dan diaduk. pH-nya disesuaikan menjadi 7,5 menggunakan 0,1N HCI atau 0,1N NaOH sesuai kebutuhan. Labu dipanaskan untuk melarutkan agar-agar dalam media sepenuhnya.
- Media cair ini disebarkan ke dalam 5 tabung reaksi (masing-masing 2 ml), disumbat dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Bahan-bahan media agar keras tripton atau bubuk siap pakai yang diperlukan untuk 100 ml media ditimbang dan dilarutkan dalam 100 ml air suling dalam labu berbentuk kerucut 250 ml dengan pemanasan setelah penyesuaian pH hingga 7,5. Labu ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- 10 tabung kaldu tripton, 5 tabung agar lunak tripton dan labu berisi media agar keras tripton disterilkan pada suhu 121°C (tekanan 15 psi) selama 15 menit dalam autoklaf.
- Media hard agar tryptone yang telah disterilkan dalam labu berbentuk kerucut dituangkan ke dalam 5 cawan petri steril secara aseptis untuk mendapatkan 5 cawan agar hard tryptone.
- Satu ml biakan stok bakteriofag (Mis: T2 coliphage ) dipindahkan secara aseptis, sebaiknya dalam ruang aliran laminar, ke tabung kaldu tryptone (9 ml) menggunakan pipet steril. Ini menjadi pengenceran 10 kali (yaitu 10 -1 ). Ini secara aseptis diencerkan secara berurutan ke sembilan tabung kaldu lainnya, sehingga mendapatkan pengenceran akhir 10 -10 (Gambar 8.4).
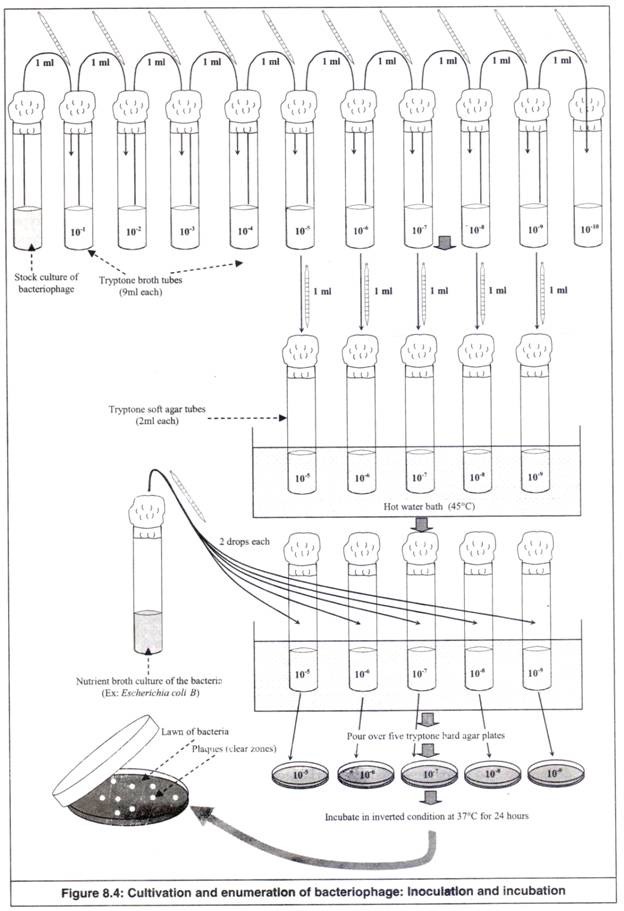
- 5 tabung agar lunak tryptone yang telah disterilkan diambil dan dipanaskan di atas penangas air hingga 100°C, sehingga agar agar meleleh. Tabung didinginkan dan tabung lunak lunak cair dipertahankan pada suhu 45°C.
- Dari 10 tabung di atas yang berisi fag dengan konsentrasi berbeda, lima tabung (yaitu 10 -5 , 10 -6 , 10 -7 , 10 -8 dan 10 -9 ) dipilih. Dari tabung ini, secara aseptik masing-masing 1 ml dipindahkan ke lima tabung agar lunak tryptone menggunakan pipet steril terpisah.
- Dua tetes biakan kaldu nutrien dari bakteri (Mis: Escherichia coli B) dipindahkan secara aseptis, sebaiknya dalam ruang aliran laminar, ke setiap tabung agar lunak tryptone yang mengandung bakteriofag pada lima konsentrasi berbeda (10 -5 hingga 10 -9 ).
- Isi lima tabung agar lunak tryptone yang berisi bakteriofag dan bakteri bercampur dengan cepat dengan memutar di antara telapak tangan.
- Isinya dituangkan secara aseptis di atas lima lempeng agar keras tripton berlabel 10 -5 hingga 10 -9 , sehingga membentuk sediaan biakan lempeng lapis ganda. Pelat diaduk dengan lembut dan dibiarkan mengeras.
- Pelat diinkubasi dengan posisi terbalik pada suhu 37°C dalam inkubator.
Pengamatan:
- Semua pelat diamati untuk unit pembentuk plak (PFU) yang berkembang sebagai zona bening di halaman rumput bakteri.
- Hanya pelat yang memiliki PFU antara 30 dan 300 yang dipertimbangkan untuk pencacahan fag. Jumlah PFU pada setiap pelat dihitung. Pelat yang menunjukkan lebih dari 300 PFU ditetapkan sebagai ‘terlalu banyak untuk dihitung’ (TNTC), sedangkan pelat yang menunjukkan kurang dari 30 PFU ditetapkan sebagai ‘terlalu sedikit untuk dihitung’ (TFTC). Pelat seperti itu tidak dipertimbangkan.
- Berdasarkan pengamatan, jumlah bakteriofag per ml biakan stok fag dihitung dengan menggunakan rumus berikut.
Jumlah fag/ml = Jumlah faktor pengenceran X PFU
Misalnya, jika jumlah PFU adalah 280 dalam pengenceran 10 -7 , maka jumlah fag dalam kultur stok fag adalah 280 X 10 7 fag/ml (= 2,80 X 10 9 fag/ml).



