Baca artikel ini untuk mempelajari tentang estimasi beberapa atribut polutan yang umum: 1. Residu Total 2. Residu Terlarut 3. Padatan Tetap dan Padatan Volatile 4. Padatan Tersuspensi 5. Padatan Tersuspensi Tetap 6. Kekeruhan 7. Warna 8. Bau 9. Konduktivitas 10. Kekerasan 11. Alkalinitas 12. Alkalinitas 13. pH 14. Temperatur 15. Minyak, Lemak dan Gemuk dan Lainnya.
Residu Total:
Residu total sampel air limbah diperkirakan dengan menguapkan dan mengeringkan volume sampel yang diketahui dalam oven saat dikumpulkan/diterima, yaitu, bersama dengan padatan tersuspensi terkait, jika ada, dalam wadah kering yang ditimbang pada suhu 103-105 °C. Pertambahan berat cawan mewakili total residu sampel dan dinyatakan dalam satuan mg/L.
Residu Terlarut:
Ketika proses yang diuraikan di bawah residu total dilakukan dengan volume yang diketahui, sampel air limbah yang disaring, peningkatan berat wadah akan mewakili jumlah padatan terlarut yang ada dalam sampel. Itu juga dinyatakan dalam satuan mg / L.
Padatan Tetap dan Padatan Volatile:
Crucible yang mengandung residu total dibakar dalam tanur pada suhu sekitar 500°C. Akibatnya, bahan organik yang ada dalam residu akan terbakar dan bahan anorganik dapat diubah menjadi oksidanya. Wadah dengan isinya didinginkan hingga suhu kamar dan kemudian beberapa mililiter larutan amonium karbonat ditambahkan ke wadah untuk melembabkan residu.
Terakhir, crucible beserta isinya dikeringkan dalam oven pada suhu 103-105 °C. Berat residu akan mewakili padatan tetap, yang dinyatakan dalam satuan mg/L. Selisih antara Total Residu dan Fixed Solids akan mewakili Volatile Solids (VS) dalam sampel air limbah.
Padatan Tersuspensi (SS):
Untuk memperkirakan kandungan padatan tersuspensi dari sampel air limbah, volume sampel yang diketahui disaring melalui lapisan asbes yang dicuci asam-alkali setebal 2 mm dalam wadah Gooch. Crucible beserta padatan yang tertahan dikeringkan dalam oven pada suhu 103-105 °C dan ditimbang. Kenaikan berat di atas berat kering awal wadah dengan alas asbes akan menjadi berat Padatan Tersuspensi yang terkumpul. Itu dinyatakan dalam satuan mg / L.
Padatan Tersuspensi Tetap:
Wadah Gooch yang mengandung padatan tersuspensi kering harus mengalami prosedur yang sama seperti yang diuraikan dalam Padatan Tetap dan Padatan Volatile. Berat residu akhir akan mewakili Padatan Tersuspensi Tetap dari sampel.
Kekeruhan:
Kekeruhan sampel air dinyatakan dalam Jackson Candle Unit (JCU). Meteran lilin dikalibrasi menggunakan air dari sumber alami atau suspensi Kaolin yang disiapkan khusus dalam air. Dasar pengukuran kekeruhan adalah fakta bahwa partikel padat halus yang tersuspensi dalam cairan mengganggu transmisi cahaya datang melalui penyerapan dan hamburan.
Tingkat interferensi tergantung pada konsentrasi, ukuran dan warna partikel serta warna cairan. Oleh karena itu, uji kekeruhan sampel cairan tidak mengungkapkan perkiraan yang tepat dari jumlah partikel tersuspensi halus yang ada dalam sampel. Namun, ini memberikan ukuran tidak langsung dari jumlah partikel padat tersuspensi halus yang ada dalam sampel.
Metode klasik untuk pengukuran kekeruhan terdiri dari menuangkan sampel air keruh ke dalam tabung kaca standar dengan alas datar panjang di mana lilin standar yang menyala ditempatkan. Penuangan lebih lanjut dari sampel dilanjutkan sampai profil nyala dilenyapkan. Ketinggian sampel dalam tabung berbanding terbalik dengan kekeruhannya.
Untuk memperkirakan kekeruhan sampel, ketinggiannya dalam tabung kaca ditemukan seperti diuraikan di atas. Dengan cara yang sama, ketinggian sampel kekeruhan yang diketahui diketahui. Dari data tersebut kekeruhan sampel dihitung.
Praktik saat ini tidak menggunakan metode klasik tetapi menggunakan fotometer (berdasarkan prinsip penyerapan cahaya) atau nephelometer (berdasarkan prinsip hamburan cahaya). Ketika nefelometer digunakan, kekeruhan sampel dinyatakan dalam NTU (satuan kekeruhan naphelometric).
Warna:
Dasar pengukuran warna adalah perbandingan warna sampel air dengan sampel air standar yang diwarnai dengan kalium kloroplatinat dan kobaltous klorida (dicampur dalam proporsi yang berbeda). Sampel yang akan diuji harus disentrifugasi untuk menghilangkan partikel tersuspensi (termasuk koloid) sebelum pengujian warnanya.
Metode klasik adalah mengambil sampel air bebas-padat tersuspensi dalam tabung Nessler dan membandingkan warnanya dengan warna sampel standar dalam tabung Nessler. Praktik saat ini adalah menggunakan kolorimeter fotolistrik.
Bau:
Instrumen yang tepat untuk identifikasi dan estimasi kuantitatif bau dari sampel air limbah belum dikembangkan. Pengujian sepenuhnya tergantung pada indra penciuman penguji. Bau dari sampel air limbah pada awalnya diidentifikasi sebagai bau alami yang diketahui dan kemudian dikuantifikasi sebagai angka bau ambang.
Jumlah bau ambang sampel adalah rasio pengenceran di mana bau hampir tidak dapat dideteksi dengan mengendus. Pengenceran harus dilakukan dengan air bebas bau. Sniffing dapat dilakukan pada suhu 20 °C (kualitas bau dingin) atau pada suhu 58-60 °C (kualitas bau panas).
Daya konduksi:
Konduktivitas listrik spesifik dari sampel air dinyatakan dalam micro-mho/cm atau µS cm -1 . Itu tergantung pada konsentrasi zat terionisasi terlarut yang ada dalam sampel air dan suhu di mana pengukuran dilakukan. Konduktansi spesifik meningkat dengan peningkatan konsentrasi ionik dan suhu. Konduktivitas terkadang dinyatakan dalam mg/L total padatan terlarut (TDS).
Konduktivitas listrik sampel dalam mikro-mho/cm atau µS cm -1 pada 25 °C bila dikalikan dengan faktor tertentu memberikan perkiraan kasar anorganik terlarut yang ada dalam sampel dalam satuan mg/L. Faktor adalah sekitar 0,55 untuk sampel yang mengandung konsentrasi asam/basa bebas yang cukup besar dan sekitar 0,70 hingga 0,75 ketika sampel cukup asin.
Instrumen yang biasanya digunakan untuk pengukuran konduktivitas adalah sel konduktivitas pelat paralel bersama dengan unit jembatan Wheatstone atau sensor potensiometrik multi-elektroda. Untuk pengukuran konduktivitas, sampel bebas-padat tersuspensi akan digunakan.
Kekerasan:
Kesadahan air adalah ukuran kapasitasnya untuk mengendapkan sabun. Sabun diendapkan terutama oleh ion Ca dan Mg yang umumnya terdapat dalam air. Ion logam polivalen lainnya seperti Al, Fe, Mn, Sr, Zn juga menyebabkan kesadahan. Kekerasan menyebabkan pengotoran pertukaran panas.
Untuk mengevaluasi kekerasan sampel air perlu memperkirakan konsentrasi masing-masing ion yang disebutkan di atas dalam sampel. Kekerasan sampel air dilaporkan sebagai setara CaCO 3 (mg/L, CaCO 3 ).
Ini dihitung dengan mengalikan konsentrasi setiap kation polivalen (dalam mg/L) dengan faktor tertentu dan menjumlahkan produk tersebut. Metode yang kurang akurat adalah memperkirakan konsentrasi ion Ca dan Mg hanya dengan titrasi EDTA dan menghitung kekerasan berdasarkan informasi tersebut.
Alkalinitas:
Alkalinitas sampel air mencerminkan kapasitasnya untuk menetralkan asam kuat ke pH yang ditentukan. Diperkirakan dengan menitrasi volume sampel air yang diukur dengan larutan standar asam sulfat atau asam klorida ke titik akhir (pH) yang telah dipilih sebelumnya. Titrasi dapat dilakukan dengan menggunakan indikator (bromocresol green-methyl red) atau dengan bantuan Titrator Potensiometrik.
pH:
PH sampel air adalah ukuran keasaman atau kebasaannya. Secara kuantitatif,
pH = Log 10 1/[H + ]
di mana [H + ] adalah singkatan dari konsentrasi ion hidrogen yang dinyatakan dalam g-ion/liter sampel.
Hasil kali ion air dinyatakan dengan Kw = [H + ] x [OH – ]. Nilai numeriknya adalah 10 -14
Jika konsentrasi ion hidrogen [H + ] dalam sampel air lebih banyak daripada ion hidroksil [OH- ] maka sampel tersebut disebut asam. Ketika mereka ([H + ] dan [OH – ]) adalah sama, yaitu, masing-masing memiliki konsentrasi 10 -7 g-ion/L sampel disebut netral.
Namun, jika konsentrasi ion hidroksil dalam sampel lebih dari ion hidrogen, maka itu disebut basa. PH sampel air asam dapat berkisar antara 0 hingga 7 dan sampel basa antara 7 hingga 14.
PH sampel air dapat diperkirakan kira-kira dengan menggunakan beberapa larutan kimia organik (disebut sebagai indikator) yang berubah warna pada beberapa konsentrasi ion hidrogen/hidroksil tertentu. Untuk mengukur pH-akurat sekarang satu hari pH-meter digunakan yang terdiri dari probe pH dan meteran milivolt.
Probe pH adalah rakitan elektroda kaca berselubung ion hidrogen yang permeabel dan elektroda referensi. Perbedaan ggl antara elektroda kaca dan elektroda pembanding bergantung pada konsentrasi ion hidrogen dari sampel air tempat probe dicelupkan, dan temperaturnya. Milivolt-meter yang dibuat khusus untuk probe tertentu dilengkapi dengan elemen kompensasi suhu. Meter lulus dalam hal milivolt serta pH.
Suhu:
Suhu sampel air dapat diukur dengan bantuan termometer cair-dalam-kaca atau termokopel atau termometer resistansi. Untuk mengukur suhu aliran yang mengalir atau badan air termokopel biasanya digunakan. Suhu yang diukur biasanya dilaporkan dalam °C.
Minyak, Lemak dan Gemuk:
Minyak, lemak, dan gemuk dapat hadir dalam bentuk bebas atau dalam bentuk emulsi dalam air limbah. Ini tidak larut dalam air tetapi larut dalam berbagai pelarut organik. Untuk perkiraan ini dalam sampel air, mereka diekstraksi dari volume sampel yang diketahui dengan fraksi minyak bumi ringan (disebut petroleum eter) yang memiliki kisaran titik didih 40 hingga 60 °C. Dari ekstrak sebagian besar petroleum eter akan didistilasi dengan menyisakan sebagian kecil pelarut bersama dengan minyak, lemak, dan lemak yang diekstraksi. Akhirnya, jejak terakhir dari pelarut harus diuapkan pada penangas air dalam aliran udara hangat. Berat residu yang tersisa adalah berat minyak, lemak, dan gemuk yang ada dalam sampel. Dinyatakan dalam satuan mg/L.
Oksigen Terlarut:
Kelarutan oksigen dalam air rendah. Konsentrasi saturasi oksigen dalam air tergantung pada suhu air dan tekanan oksigen superincumbent. Tabel 7.1 menunjukkan kelarutan oksigen dari udara (pada tekanan 1 atm) dalam air tawar pada temperatur yang berbeda.
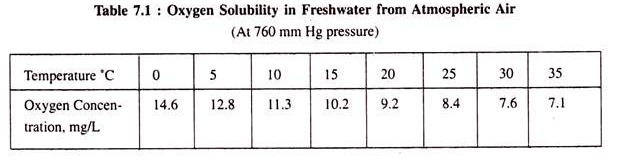
Karena flora dan fauna air, termasuk mikro-organisme air, memenuhi kebutuhan oksigennya dari oksigen terlarut, perkiraannya sangat penting untuk menilai kualitas badan air/sungai. Metode klasik untuk estimasi oksigen terlarut (DO) dikenal sebagai metode Winkler.
Metode Winkler dilakukan melalui tiga langkah berikut:
Langkah-I:
Volume sampel yang diketahui untuk diuji dicampur dengan larutan mangan sulfat (MnSO 4 ) dan kalium iodida basa (NaOH dan KI).
Akibatnya terjadi reaksi sebagai berikut:

Campuran kemudian diasamkan dengan asam sulfat dimana yodium dibebaskan sesuai dengan reaksi.
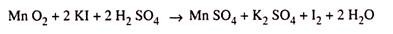
Akhirnya, yodium yang dibebaskan diperkirakan secara kuantitatif dengan titrasi dengan larutan standar natrium tiosulfat dengan adanya pati sebagai indikator menurut reaksi di bawah ini:
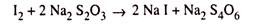
Karena semua reaksi yang disebutkan di atas terjadi secara kuantitatif, dimungkinkan untuk memperkirakan konsentrasi oksigen terlarut dalam sampel dari volume dan konsentrasi larutan tiosulfat yang digunakan untuk menitrasi iodin yang dibebaskan. Oksigen terlarut dinyatakan dalam satuan mg O 2 per liter sampel.
Metode Winkler yang dimodifikasi dengan sesuai digunakan ketika bahan kimia yang mengganggu, seperti garam nitrat, nitrogen, besi dan besi, dll., Ada dalam sampel. Estimasi oksigen terlarut dengan metode Winkler membutuhkan tangan terampil. Ini bukan metode yang nyaman untuk estimasi DO di lapangan.
Praktik saat ini adalah menggunakan perangkat listrik yang terdiri dari probe DO dan mikro-ammeter. Probe DO terdiri dari dua elektroda yang diisolasi satu sama lain dan rakitannya ditutupi dengan membran permeabel oksigen.
Ketika probe seperti itu dicelupkan ke dalam sampel air, oksigen terlarut meresap melalui membran dan sel galvanik diatur sebagai akibatnya arus mengalir melalui ammeter yang menghubungkan kedua elektroda.
Besarnya arus bergantung pada laju perembesan oksigen, yang pada gilirannya bergantung pada konsentrasi oksigen terlarut dalam sampel. Metode ini sangat cepat. Ini dapat digunakan di laboratorium maupun di lapangan. Selain itu, tidak diperlukan keterampilan untuk menggunakan instrumen semacam itu.
Permintaan Oksigen Biokimia (BOD):
Zat organik terlarut dan tersuspensi yang ada di badan/aliran air dapat menjadi makanan bagi mikroorganisme yang ada di dalamnya. (Mikroorganisme ada di mana-mana kecuali ada perawatan khusus untuk mengeluarkannya dari area tertentu). Proses asimilasi zat organik terlarut/dan atau tersuspensi oleh organisme aerob terjadi melalui serangkaian reaksi yang disebut jalur biokimia. Dalam beberapa reaksi ini, oksigen terlarut dalam air akan ikut serta, akibatnya konsentrasi oksigen terlarut dalam air akan berkurang.
Tingkat penipisan oksigen dalam badan air / aliran akan tergantung pada faktor-faktor berikut:
- Spesies organisme yang ada dan populasinya,
- Sifat dan konsentrasi zat organik yang ada,
- Suhu, dan
- Konsentrasi oksigen terlarut.
Penipisan total DO akan bergantung pada waktu yang telah berlalu sejak awal proses serta faktor-faktor yang telah disebutkan. Perlu dicatat di sini bahwa tingkat penipisan DO dalam sampel air selama proses mikroba aerobik bukanlah indeks sebenarnya dari total zat organik yang ada dalam sampel, tetapi mewakili sejauh mana biodegradasi zat organik telah terjadi. oleh mikroba yang ada.
Karena penipisan DO tergantung pada durasi proses dan faktor, prosedur standar telah dikembangkan untuk melakukan pengujian sehingga memperoleh beberapa informasi tentang zat organik yang dapat terbiodegradasi yang ada dalam sampel.
Atribut ini disebut sebagai BOD 5 20 °c- Pada dasarnya BOD 5 20 °c mewakili mg oksigen yang digunakan oleh mikroba saat memetabolisme zat organik dalam sampel satu liter dalam kondisi aerobik pada suhu 20 °C selama periode Lima hari
Pendekatan dasar untuk estimasi BOD 5 20 °c adalah dengan mengencerkan volume terukur dari sampel dengan volume yang cukup dari air suling jenuh udara yang telah dicampur sebelumnya dengan beberapa nutrisi mikroba. Botol BOD standar berkapasitas 300 ml diisi dengan campuran dan ditutup untuk mencegah udara yang terperangkap dan untuk mencegah masuknya udara.
Botol diinkubasi pada suhu 20 °C selama 5 hari. Botol BOD lainnya diisi dengan air suling jenuh udara yang telah diinokulasi sebelumnya dicampur dengan nutrisi mikroba dan diinkubasi pada 20 ° C selama 5 hari. DO campuran ditentukan sebelum dan sesudah inkubasi.
Berdasarkan data tersebut BOD sampel dihitung sebagai berikut:
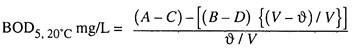
Di mana A = DO awal sampel dicampur dengan air pengenceran yang diinokulasi,
B = DO awal air pengenceran yang diinokulasi saja,
C = DO sampel dicampur dengan air pengenceran yang diinokulasi setelah inkubasi selama 5 hari,
D = DO air pengencer yang diinokulasi hanya setelah inkubasi selama 5 hari,
Ï’ = volume dalam liter sampel yang ditambahkan ke dalam botol BOD, dan
V = volume dalam liter botol BOD.
Proses oksidasi biokimia tidak selesai dalam waktu 5 hari tetapi berlangsung selama beberapa hari. Oleh karena itu BOD 5 bukanlah ukuran dari total oksigen yang dibutuhkan untuk oksidasi biokimia lengkap dari zat organik biodegradable yang ada dalam sampel air. Total permintaan oksigen biokimia disebut sebagai BOD ultimate (BOD ult ).
Biasanya diasumsikan bahwa proses pengambilan oksigen selama estimasi BOD mengikuti persamaan laju orde pertama. Berdasarkan asumsi ini BOD ult mungkin terkait dengan data BOD untuk periode yang lebih singkat dengan persamaan berikut;
BOD, = BOD Ult (le -kt ) (7.1)
di mana k = konstanta laju orde pertama, dan
t = masa inkubasi dalam hari.
Sejak Persamaan. (7.1) memiliki dua buah yang tidak diketahui, yaitu BOD ult dan k, untuk pendugaan tersebut perlu diketahui secara eksperimental BOD pada waktu t 1 dan t 2 .
Persamaan. (7.1) mungkin valid jika zat organik yang ada dalam sampel air sebagian besar mengandung karbon dan fraksi protein yang dapat diabaikan. Gambar 7.1 menunjukkan bagaimana BOD sampel berubah seiring dengan waktu (masa inkubasi) ketika sejumlah besar protein hadir bersama dengan bahan karbon dalam sampel air.
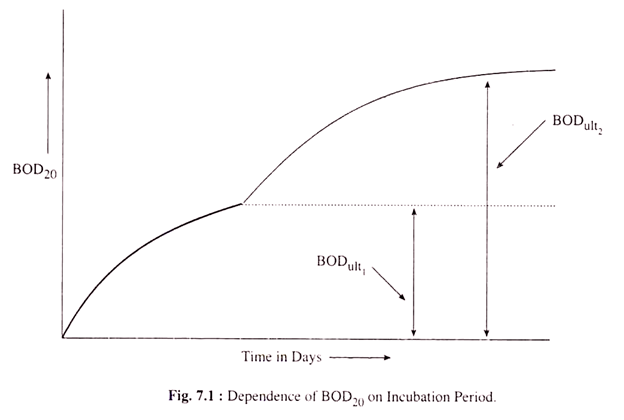
BOD ult = BOD ult untuk bahan yang terutama mengandung karbon,
BOD ult2 = BOD ult untuk bahan karbon dan protein,
Kelemahan utama metode estimasi BOD yang diuraikan di atas adalah bahwa seseorang harus menunggu selama 5 hari untuk mengevaluasi BOD 5 sampel. Oleh karena itu metode ini tidak cocok untuk pemantauan proses. Karena kelemahan ini beberapa instrumen telah dikembangkan dengan bantuan yang dapat memperkirakan BOD sampel air dalam waktu singkat, katakanlah, satu setengah sampai dua jam.
Permintaan Oksigen Kimia (COD):
Telah disebutkan sebelumnya bahwa dibutuhkan 5 hari untuk menyelesaikan tes BOD.
Selain itu, tes ini mengungkapkan informasi yang tidak lengkap tentang jumlah total zat organik yang ada dalam sampel air karena alasan berikut:
- Selama pengujian ini, hanya sebagian dari bahan organik biodegradable terlarut yang teroksidasi dan sebagian kecil bahan organik biodegradable tersuspensi yang teroksidasi.
- Tidak ada zat organik non-biodegradable yang teroksidasi, dan
- Tidak ada zat anorganik yang teroksidasi.
Untuk mengatasi kekurangan tersebut BOD 5 2Q . Uji C , suatu uji telah dikembangkan di mana semua zat organik yang dapat teroksidasi baik yang dapat terurai secara hayati maupun yang tidak dapat terurai secara hayati serta zat anorganik yang dapat teroksidasi dioksidasi dengan reagen pengoksidasi kimia dalam waktu yang lebih singkat. Ini disebut sebagai uji Permintaan Oksigen Kimia (COD).
Pengujian dilakukan dengan merefluks sejumlah sampel air dengan volume terukur larutan kalium dikromat (K 2 Cr 2 O 7 ) dengan konsentrasi yang diketahui dan larutan asam sulfat pekat dalam jumlah proporsional. Selama refluks, semua zat yang dapat teroksidasi dioksidasi menjadi oksidanya masing-masing.
Reaksi dapat dinyatakan sebagai:
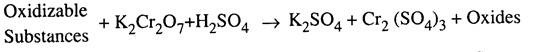
Setelah proses refluks selesai, jumlah kalium dikromat yang berlebih (tidak bereaksi) diperkirakan dalam cairan yang direfluks dengan menitrasi sebagian darinya dengan larutan ferro amonium sulfat (garam Mohr) standar dengan adanya indikator Ferroin. Reaksi yang terjadi selama titrasi adalah
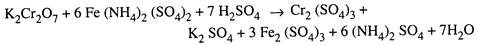
Berdasarkan data yaitu volume larutan dikromat yang direaksikan (selama refluks), konsentrasinya dan volume sampel (air) yang digunakan, COD dihitung dan dilaporkan sebagai mg O 2 /L sampel air. Harus diperhatikan bahwa beberapa senyawa aromatik, seperti benzena, toluena, piridin jika ada dalam sampel air tidak teroksidasi selama refluks.
Nutrisi Tanaman:
Nutrisi tumbuhan umum yang mungkin ada dalam air limbah industri adalah senyawa nitrogen dan fosfor. Ketika limbah yang mengandung senyawa pembawa nitrogen dan/atau fosfor dibuang ke badan air, maka pertumbuhan tanaman air termasuk ganggang akan meningkat di badan air. Peningkatan pertumbuhan seperti itu disebut sebagai ganggang mekar. Tumbuhan itu akan menggunakan oksigen terlarut yang ada di badan air. Selanjutnya tanaman akan mengalami biodegradasi tanpa adanya oksigen, yaitu proses eutrofikasi akan dimulai.
Karena degradasi anaerobik tanaman air (termasuk ganggang), badan air akan menjadi kotor dan gas berbau busuk akan dikeluarkan. Oleh karena itu estimasi nutrisi tanaman yang ada dalam aliran air limbah perlu dilakukan untuk memungkinkan seseorang merancang skema pengolahan yang sesuai.
Estimasi Nitrogen:
Nitrogen dapat hadir dalam aliran air limbah dalam bentuk amonia bebas, garam amonikal, asam amino, dll. Senyawa nitrogen ini dapat diperkirakan dengan metode Kjeldahl. Namun, metode ini tidak dapat digunakan untuk memperkirakan nitrogen, jika hadir sebagai nitrit, nitrat, azida, nitro, nitroso, dan oksimat dalam sampel air.
Prinsip dasar metode Kjeldahl adalah memanaskan sampel yang mengandung senyawa nitrogen dengan katalis asam sulfat, kalium sulfat, dan merkuri sulfat. Selama proses ini senyawa nitrogen yang ada dalam sampel diubah menjadi amonium bi-sulfat. Campuran dibuat basa dengan menambahkan soda kaustik dan suling.
Larutan ammonik berair disuling yang dikumpulkan. Amonium hidroksida yang ada dalam distilat kemudian diperkirakan secara kolorimetri. Nitrogen yang diperkirakan dengan cara ini dinyatakan (sebagai N) dalam satuan mg/L. Reagen yang digunakan untuk metode kolorimetri adalah larutan air merkuri iodida dan natrium hidroksida.
Estimasi Fosfor:
Fosfor dapat hadir dalam sampel air limbah sebagai fosfat anorganik, seperti piro, metatripoli dan ortofosfat serta senyawa organofosfor. Estimasi fosfor total dilakukan dengan mengubah semua senyawa fosfor yang ada menjadi ortofosfat dengan merebus sampel air dengan kalium persulfat dan asam sulfat. Ortofosfat yang dihasilkan kemudian diperkirakan secara kolorimetri
Metode kolorimetri terdiri dari penambahan larutan amonium molibdat dan asam amino-naptolsulfonat yang diasamkan atau larutan amonium molibdat dan stannous klorida ke dalam larutan ortofosfat encer. Ini menimbulkan warna biru yang intens. Kandungan fosfor sampel dinyatakan (sebagai P) dalam satuan mg/L.
Penilaian Bakteriologis:
Air limbah dapat mengandung organisme patogen (penyebab penyakit) serta organisme non-patogen. Dari sudut pandang kesehatan masyarakat keberadaan patogen dalam limbah akan mengkhawatirkan karena akan mencemari badan air tempat limbah dibuang. Oleh karena itu, kehati-hatian harus dilakukan agar limbah yang terkontaminasi tidak masuk ke badan air tanpa desinfeksi sebelumnya.
Untuk menghindari kemungkinan tersebut, perlu dipastikan apakah suatu limbah mengandung patogen atau tidak. Ini adalah tugas yang sulit, karena tidak ada tes umum untuk mendeteksi spesies patogen yang berbeda. Untuk mengatasi kesulitan ini praktiknya adalah mencoba mendeteksi bakteri coliform (Bact. Coli.) yang hampir selalu ada bersama dengan patogen lainnya. Coliform mudah dideteksi.
Mereka bertahan hidup dalam jangka waktu yang lama. Coliform seperti patogen yang ditularkan melalui air lainnya berada di saluran pencernaan hewan berdarah panas dan karenanya keberadaan coliform dalam sampel air limbah merupakan bukti kontaminasi ekskresi aliran air limbah baru-baru ini. Kehadiran coliform dalam sampel berarti bahwa patogen lain mungkin juga ada.
Ada atau tidaknya coliform dalam sampel air dapat dipastikan dengan melakukan tes berikut:
(A) Tes dugaan,
(B) Tes yang dikonfirmasi, dan
(C) Tes selesai.
Pengujian dilakukan dengan menginokulasi tabung fermentasi kaldu laktosa atau lauril triptosa dengan sebagian sampel dan menginkubasinya selama 24-48 jam pada suhu 35 ± 0,5 °C. Produksi gas selama inkubasi akan mengindikasikan adanya koliform dalam sampel.
Bioassay:
Tujuan dari melakukan tes bioassay adalah untuk memastikan apakah aliran limbah air limbah beracun dan jika demikian, sampai sejauh mana. Limbah mungkin mengandung zat beracun anorganik dan/atau organik. Untuk masing-masing zat yang merupakan racun, telah ditentukan batas ambangnya. Oleh karena itu, jika diketahui zat atau zat beracun spesifik mana yang ada dalam aliran limbah, maka seseorang dapat secara analitis memperkirakan konsentrasinya masing-masing dan memutuskan tentang toksisitas aliran tersebut.
Namun, identifikasi zat beracun yang ada dalam sampel dan perkiraan konsentrasinya membosankan. Selain itu, toksisitas sampel bukanlah sifat aditif. Kadang-kadang efek racun bersifat sinergis dan kadang-kadang antagonis. Oleh karena itu, perlu untuk memastikan toksisitas sampel air limbah dengan bioassay.
Informasi spesifik yang dapat diperoleh dengan melakukan uji bioassay adalah apakah limbah ketika dibuang ke badan air akan berdampak buruk pada flora dan fauna airnya, khususnya spesies ikan yang ada.
Pengujian dilakukan di akuarium laboratorium untuk memastikan pengenceran minimum aliran limbah mana yang membuatnya tidak beracun bagi ikan. Untuk uji laboratorium, air pengencer yang digunakan dapat berasal dari sumber alami atau disiapkan di laboratorium dengan menambahkan beberapa bahan kimia ke dalam air suling.
Uji kontrol juga dilakukan dengan menggunakan air pengencer saja. Spesies ikan yang akan digunakan untuk pengujian harus dipilih dengan hati-hati dan harus disesuaikan dengan kondisi pengujian sebelum melakukan percobaan laboratorium.



