Pada artikel ini akan dibahas tentang kriopreservasi gamet pada ikan.
Kriopreservasi adalah teknik penyimpanan yang praktis tanpa batas waktu. Pengawetan gamet ikan telah dicoba dengan teknik ini. Kriopreservasi sperma adalah prosedur mapan dalam peternakan.
Sekarang sperma cryopreserved berhasil digunakan dalam inseminasi sapi, kuda, babi, domba dan peternakan unggas. Sangat menarik untuk dicatat bahwa upaya besar telah dilakukan untuk mentransfer teknologi ini ke pengawetan sperma, ovum dan embrio ikan.
Teknik ini akan membantu pembudidaya ikan dengan cara-cara berikut:
(1) Masalah pematangan jantan dan betina yang tidak kebetulan dapat diatasi, jika sperma atau ovum disimpan di gudang.
(2) Program pemuliaan selektif dapat dilakukan yang akan meningkatkan stok asli dan akan membantu dunia ketiga untuk membiakkan spesies asli mereka dan menghasilkan galur khusus batang unggul.
(3) Teknik kriopreservasi gamet akan memainkan peran penting dalam konservasi plasma nutfah asli karena banyak ikan asli India tidak dapat bersaing dengan ikan eksotis. Dengan teknik ini, gamet dari spesies yang terancam dibelokkan sebagai lindung nilai terhadap berkurangnya variabilitas genetik yang disebabkan oleh gangguan lingkungan.
(4) Dapat membantu dalam produksi budaya mono-seks.
(5) Jika gamet dapat berhasil dilestarikan, kita dapat mengembangkan ikan sepanjang tahun sesuai kebutuhan kita dan dapat membantu membangun bank gen untuk melestarikan orisinalitas genetik populasi dan membuatnya tetap tersedia untuk introduksi kembali ketika kondisi umum untuk bertahan hidup telah membaik.
Sperma, telur, dan embrio dapat dikriopreservasi, tetapi pengawetan telur dan embrio sulit dilakukan karena tidak tersedianya krioprotektan untuk diserap secara memadai dalam sel-sel ini karena ukurannya yang besar dibandingkan dengan spermatozoa.
Kriopreservasi spermatozoa pada ikan berhasil dilakukan pada manusia; spesies Spesies ini adalah Oncorhynchus, Salmo, Salvilinus fontinalis, Hucho hucho, Thymallus thymallus, Esox lucius dan Cyprinus carpio, Serothodon mossambicus; Labeo rohita, Catla catla dan Cirrhinus mrigala.
Berikut langkah-langkah yang harus diikuti dalam mengawetkan spermatozoa:
(1) Koleksi milt (air mani).
(2) Persiapan larutan ekstender.
(3) Pemilihan krioprotektan.
(4) Pembekuan.
(5) Sukses dalam pembuahan.
Koleksi Milt:
Langkah pertama adalah mengumpulkan sperma. Biasanya sperma dikumpulkan dari ikan sehat dengan metode pengupasan. Kateter dapat digunakan, yang merupakan alternatif yang lebih baik daripada pengupasan. Indukan jantan dengan sifat-sifat terbaik dipilih dan dicuci dengan larutan Ringers dan daerah genital papila dikeringkan.
Brooder dapat dibius atau tidak dibius. Anestesi yang umumnya digunakan adalah 0,3 ml/l fenoksietanol. Menurut Kumar (1989), injeksi suston 250 (organon) sebelum pengupasan memberikan hasil yang lebih baik pada ikan mas India. Mayoritas pekerja di bidang ini merekomendasikan ikan yang tidak dibius untuk pengupasan untuk mendapatkan milt.
Milt dikumpulkan dalam jarum suntik atau tabung hemolisis dan kemudian diawetkan dalam ampul kaca (tersegel atau tidak bersegel), sedotan plastik dan seringkali dalam kantong plastik. Warna, volume, kepadatan, pH dan motilitas sperma harus diperhatikan.
Sampel harus bebas dari urin dan feses. Apusan sampel akan diperiksa di bawah mikroskop untuk melihat kelainan pada sperma. Jika sampel OK, maka diproses lebih lanjut, jika tidak, sampel segar dari indukan baru dapat diambil.
Selama masa pengumpulan dan pengawetan spermatozoa, spuit/ampul/sedotan boleh disimpan di dalam air tambak untuk menjaga suhu konstan. Legendary dan Billard (1980) mengumpulkan sperma dalam tabung hemolisis dalam es yang mencair dan kemudian disimpan di permukaan yang didinginkan pada suhu 4 °C.
Persiapan dan pemilihan extender, solusi di mana milt dikumpulkan, paling penting untuk kriopreservasi. Extender mencegah penipisan energi sperma dan mempertahankan sperma dalam kondisi diam tapi hidup.
Ada dua extender dasar. Mereka disebut medium Mounib (M) dan medium Menezo (Me). Pada kedua media tersebut ditambahkan bovine serumin (BSA) dan kuning telur telurit. Untuk ikan India, beberapa ekstender dicoba dengan memodifikasi konstituen berikut.
Konstituen yang umum adalah natrium klorida, KCI, CaCl2, NaHCO 3 , Na 2 HPO 4 , dan MgSO4. Selain itu, nutrisi & glisin juga ditambahkan untuk meningkatkan kriopreservasi . Antibiotik seperti gentomycin atau streptomycin juga ditambahkan ke larutan ekstender jika diperlukan.

Krioprotektan:
Fungsi utama cryoprotectant adalah untuk menembus sel dan dapat membantu spermatozoa untuk mentolerir suhu beku. Yang paling penting dan digunakan secara luas adalah DSMO (Dimethyl sulfoxide) dan gliserol. Harvey (1983) menggunakan metanol, DSMO dan gliserol dalam kombinasi dengan susu bubuk atau kuning telur.
Larutan cryoprotectant dan extender dalam rasio tetap, umumnya satu bagian cryoprotectant dan sembilan bagian larutan extender dikenal sebagai pengencer. Dalam pengencer ini sperma dikumpulkan untuk diproses lebih lanjut untuk pembekuan.
Pengencer (cryoprotectant + extender + sperma) diambil dalam sedotan polivinil dan kedua ujung sedotan disegel dan sekarang siap untuk dibekukan atau didinginkan. Milt dapat didinginkan, suhu dipertahankan antara 0-5 o C. Sementara dalam pembekuan, digunakan CO 2 dan nitrogen cair Penyimpanan dingin teleost milt (0-50 o C) telah dipelajari secara ekstensif pada Salmonida.
Dalam prosedur pembekuan banyak masalah seperti kejutan dingin, pembentukan es intraseluler dan kejutan osmotik harus dikontrol. Kriopreservasi umumnya berarti penyimpanan sel atau jaringan pada -196 o C, suhu nitrogen cair (Gambar 22.1).
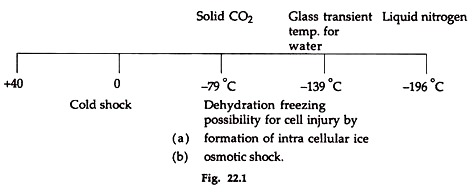
Cedera sel harus dikontrol. Tiga jenis cedera sel umumnya terjadi. Yang pertama adalah cold shock, yang disebabkan oleh pendinginan di atas suhu beku. Ini lebih penting untuk ovum, tidak terlalu penting untuk sperma.
Hal ini terjadi hingga 0°C. Ketika suhu berubah dari 0°C dan -80°C terjadi kejutan osmotik dan pembentukan es intraseluler dalam sel telur dan sperma. Untuk kriopreservasi yang berhasil, hal-hal ini dikendalikan.
Singkatnya, sedotan yang mengandung pengencer, dipindahkan ke dalam tabung. Cannister memegang sedotan setelah memungkinkan berbagai periode kesetimbangan dicelupkan terlebih dahulu ke dalam uap nitrogen cair dan kemudian ke dalam nitrogen cair pada suhu -196°C. Legendra dan Billard (1980) menyimpan sperma ikan trout pelangi dalam es kering (CO2 padat -79 °C) atau dalam nitrogen cair hingga 6 bulan.
Pada sejumlah spesies air tawar, pembekuan telah dilakukan dengan peletakan sperma yang tersuspensi ke dalam es kering. Peralihan dari 0°C ke -70°C berlangsung sekitar 2 menit menghasilkan laju 35 o C/menit. Karena laju penurunan di atas – 60°C. Hasil terbaik diperoleh dalam nitrogen cair.
Pencairan:
Pencairan adalah peristiwa kebalikan dari pembekuan. Thawing dilakukan dalam waterbath dengan suhu berkisar 10°C hingga 60°C. Keberhasilan seluruh prosedur tergantung pada motilitas spermatozoa dan kemampuan pembuahan ovum.
Stoss dan Holtz (1982) telah meningkatkan motilitas spermatozoa salmon merah muda dari 30 detik menjadi 10 menit dengan mengaktifkan larutan NaHCO 3 120 nm yang telah ditambahkan 1 BMX (3-isobutil-1-metil xanthium). Kumar (1989) menyatakan lama penyimpanan sekitar 20 hari pada L. rohita dan H. molitrix dalam kondisi kriogenik.
Telur Salmo gairdeneri, Onchorhynchus kisutch dan O.keta difiksasi dengan cara dikeluarkan melalui proses stripping dan disegel dalam kantong plastik bersama cairan selom dan disimpan di bawah oksigen pada suhu 1°C. Telur-telur tersebut kemudian dibiarkan menyebar hingga membentuk lapisan sedalam satu atau dua telur.
Telur kemudian dicampur dengan larutan ekstender dan krioprotektan dengan cara yang hampir sama seperti yang dijelaskan sebelumnya untuk sperma. Menurut Harvey dan Kelley (1984), penyimpanan ovum yang tidak dibekukan (didinginkan) cukup berhasil pada ikan salmon, dengan waktu penyimpanan beberapa minggu diperoleh melalui pendinginan telur beroksigen dalam cairan selom.



