Tujuan:
Tujuan utama budidaya bakteri adalah sebagai berikut:
- Meningkatkan jumlah bakteri sehingga diperoleh bentuk yang dapat dilihat, sebagai koloni atau suspensi.
- Isolasi bakteri.
- Pemeliharaan kultur stok murni dan kultur standar.
- Pencacahan bakteri dalam sampel.
- Deteksi bakteri tertentu yang menarik dalam sampel dan pencacahannya.
- Identifikasi bakteri dari karakteristik koloni, karakteristik pertumbuhan pada media miring dan aktivitas biokimia pada media yang berbeda.
Namun, tujuan dari percobaan ini hanya untuk menumbuhkan bakteri dari sampel cair, padat dan permukaan dalam media padat dan cair, sehingga mendapatkan mereka dalam bentuk terlihat sebagai koloni atau suspensi masing-masing.
Prinsip:
Bakteri dibiakkan dalam media cair atau padat yang disterilkan dan kaya nutrisi. Media cair, yang disebut kaldu, ditampung dalam tabung reaksi untuk membentuk ‘tabung kaldu’, sedangkan media padat, yang disebut media agar, terkandung dalam cawan petri untuk membentuk ‘pelat agar’ atau hanya ‘pelat’. Budidaya bakteri membutuhkan beberapa bahan yang diduga mengandung bakteri.
Sebagian besar benda yang kita lihat mengandung bakteri. Mereka hadir dalam kerokan gigi, makanan, tanah, air, kotoran dan bahkan di media mikrobiologi yang tidak steril itu sendiri. Suspensi homogen dari salah satu bahan yang mengandung bakteri dalam jumlah tertentu diinokulasikan ke dalam media yang telah disterilkan secara aseptik dan diinkubasi dalam inkubator pada suhu 37°C selama 24 jam.
Dalam kaldu cair, bakteri tumbuh sebagai suspensi dan membuatnya keruh. Di piring agar padat, mereka tumbuh sebagai koloni; setiap koloni tumbuh dari satu bakteri. Budidaya bakteri dilakukan dalam lima langkah berikut.
- Persiapan media
- Sterilisasi media dan barang kaca
- Inokulasi
- Inkubasi
- Pengamatan
1. Persiapan Media:
Biasanya, dalam pembuatan kaldu cair dan media semipadat, bahan-bahannya ditimbang dalam proporsi yang ditentukan dan dilarutkan dalam jumlah air yang dibutuhkan. Saat ini tersedia bubuk media siap pakai yang mengandung bahan-bahan dalam proporsi yang dibutuhkan.
Dalam persiapan media kaldu cair, jumlah bubuk yang ditentukan (seperti yang disebutkan pada label kemasan) ditimbang dan dilarutkan dalam jumlah air yang dibutuhkan dalam labu berbentuk kerucut. Bahan-bahan dilarutkan dengan pemanasan, dituangkan ke dalam tabung reaksi dan disterilkan dalam autoklaf.
Tetapi dalam persiapan pelat padat, slant dan tabung dalam, jumlah bubuk yang ditentukan (seperti yang disebutkan pada label kemasan) ditimbang dan dilarutkan dalam jumlah air yang diperlukan dalam labu berbentuk kerucut. Media yang telah disiapkan ini terlebih dahulu disterilkan dalam autoklaf kemudian dibiarkan dingin selama beberapa waktu.
Selagi masih hangat, sebelum memadat, dituang ke dalam cawan Petri atau tabung reaksi yang telah disterilkan dan dibiarkan memadat saat didinginkan hingga suhu kamar. Media dalam kondisi sangat panas tidak boleh dituangkan ke dalam wadah, karena dapat menyebabkan kondensasi air pada dinding wadah, yang jatuh ke permukaan media dan dapat menyebabkan kontaminasi.
2. Sterilisasi:
Alat gelas disterilkan dalam oven udara panas pada suhu 180°C selama 3 jam dan media dalam autoclave pada suhu 121°C (tekanan 15 psi) selama 15 menit. Peralatan kaca juga dapat disterilkan dalam autoklaf, tetapi media tidak boleh disterilkan dalam oven, karena air akan keluar dari media dan akan mengalami dehidrasi.
3. Inokulasi:
Sampel cair diasumsikan sebagai suspensi bakteri yang homogen. Oleh karena itu, untuk penanaman dalam kaldu, sampel dengan volume tertentu dipipet ke dalam kaldu secara aseptik. Untuk pembiakan pada cawan agar, volume sampel tertentu dipipet ke cawan agar padat dan disebarkan pada permukaan media secara aseptis.
Untuk sampel padat, sampel dengan berat tertentu dihomogenkan secara aseptis dalam volume tertentu garam fisiologis normal (natrium klorida 0,85%) menggunakan alu dan mortar yang disterilkan atau blender. Sebagian besar patogen manusia bersifat isotonik terhadap tubuh manusia (0,85% natrium klorida).
Biasanya rasio sampel terhadap garam adalah 1: 9 (1g + 9 ml; 10g + 90 ml; 25g + 225 ml atau 50g + 450 ml). Volume tertentu dari cairan yang telah dihomogenkan ini, yang dianggap sebagai suspensi bakteri yang homogen, dipipet secara aseptik ke dalam kaldu yang telah disterilkan dalam tabung reaksi untuk biakan kaldu. Untuk biakan pada cawan agar, suspensi cair dipipet ke permukaan cawan dan disebarkan secara aseptik.
Untuk sampel permukaan yang diambil untuk mempelajari mikrobiologi permukaan padat (atas meja, permukaan tubuh atau luka), permukaan tersebut digosok dengan swab steril. Usap disentuhkan ke permukaan pelat agar yang telah disterilkan. Dari titik sentuhan, guratan dibuat dengan loop yang disterilkan secara aseptis, untuk mengisolasi bakteri.
4. Inkubasi:
Tabung dan pelat kaldu yang telah diinokulasi diinkubasi pada suhu 37°C selama 24 jam dalam inkubator.
5. Pengamatan:
Kekeruhan dalam kaldu cair dan koloni pada cawan agar mengindikasikan pertumbuhan bakteri.
Bahan yang Dibutuhkan:
Cawan petri (6 no.), pipet 2 ml (5 no.), tabung reaksi (5 no.), labu berbentuk kerucut (masing-masing 100 ml, 250 ml dan 500 ml-l), gelas kimia 250 ml (2 no.), gelas penyebar, kotak pipet stainless steel, kertas kerajinan, benang (atau karet gelang), kapas non-penyerap, tongkat kecil, loop, etil alkohol, natrium klorida (NaCl), asam klorida 0,1N (HCI), natrium hidroksida 0,1N (NaOH ), air suling, kaldu nutrisi, agar nutrisi, sampel cair (misalnya air kolam), sampel padat (misalnya tanah), sampel permukaan (misalnya bagian atas meja, permukaan tubuh, luka), kertas pH (atau pengukur pH), alu dan lesung (atau homogeniser), pembakar bunsen, oven udara panas, autoklaf, inkubator, ruang aliran laminar.
Prosedur:
- Lima pipet (dalam kotak pipet stainless steel), enam cawan petri dan sepasang alu dan mortar (atau satu cangkir homogeniser) disterilkan pada suhu 180°C selama 3 jam dalam oven udara panas. Sebagai alternatif, mereka dapat ditutup dengan kertas kerajinan, diikat dengan benang atau karet gelang dan disterilkan dalam autoklaf bersama dengan medianya (Gambar 6.1).
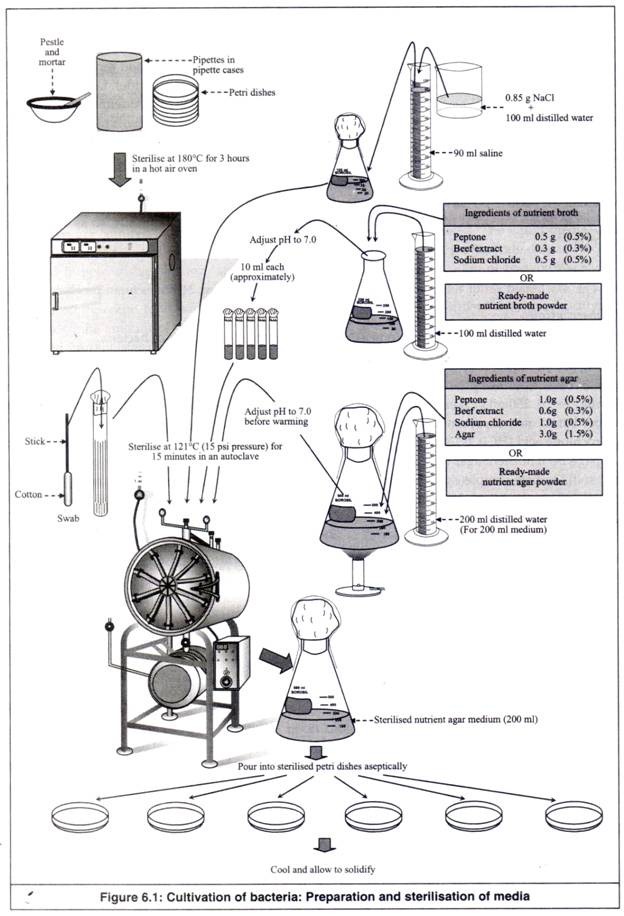
- 0,85 g NaCl dilarutkan dalam 100 ml air suling dalam gelas kimia 250 ml dan 90 ml larutan garam ini dituangkan ke dalam labu berbentuk kerucut 100 ml. Mulutnya ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Bahan media kaldu nutrisi yang dibutuhkan untuk 100 ml kaldu ditimbang. Cara lainnya, jumlah yang ditentukan dari bubuk kaldu nutrisi siap pakai (campuran bahan) ditimbang.
- Bahan (atau bubuk siap pakai) dilarutkan dalam 100 ml air suling dalam labu berbentuk kerucut 250 ml dengan cara dikocok dan diaduk. pH-nya ditentukan dengan menggunakan kertas pH atau pH meter. pH diatur menjadi 7,0 menggunakan HCl 0,1N jika lebih banyak atau menggunakan NaOH 0,1N jika lebih sedikit. Labu dipanaskan, jika perlu, untuk melarutkan bahan sepenuhnya.
- Kaldu tersebut dibagikan ke dalam 5 tabung reaksi (masing-masing kurang lebih 10 ml), mulutnya disumbat kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Bahan media nutrien agar atau bubuk siap pakai yang diperlukan sebanyak 200 ml media ditimbang dan dilarutkan dalam 200 ml air suling dalam labu berbentuk kerucut 500 ml dengan cara dikocok dan diaduk.
Ditentukan pH-nya menggunakan kertas pH atau pH meter dan diatur menjadi 7,0 menggunakan HC1 0,1N jika lebih banyak atau menggunakan NaOH 0,1N jika lebih sedikit. Labu dipanaskan untuk melarutkan agar-agar dalam media sepenuhnya. Kemudian ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Penyeka dibuat dengan memutar kapas di sekitar ujung tongkat kecil. Beberapa penyeka semacam itu disimpan dalam tabung reaksi dengan ujung kapas menghadap ke bawah. Tabung reaksi ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Labu berbentuk kerucut 100 ml dengan larutan garam 90 ml, 5 tabung reaksi dengan kaldu nutrisi, labu berbentuk kerucut 500 ml yang berisi 200 ml media agar nutrisi dan tabung reaksi yang berisi penyeka disterilkan pada suhu 121°C (tekanan 15 psi) selama 15 menit dalam autoklaf.
- Setelah sterilisasi, bahan yang telah disterilkan dikeluarkan dari autoklaf dan dibiarkan dingin beberapa saat, tanpa membiarkan media mengeras. Pendinginan medium mencegah kondensasi dan akumulasi tetesan air di dalam pelat. Jika media telah disiapkan dan dipadatkan selama penyimpanan, maka harus dicairkan dengan cara dipanaskan secara hati-hati sampai benar-benar meleleh.
- Untuk menyiapkan cawan agar nutrien, sebelum media nutrien agar yang telah disterilkan mendingin dan memadat, dalam keadaan cair yang hangat, dituangkan secara aseptis, ke dalam 6 cawan petri yang telah disterilkan (masing-masing kurang lebih 20 ml), sehingga media cair menutupi bagian bawah cawan petri sepenuhnya.
Kemudian, pelat ditutup dengan tutupnya dan dibiarkan dingin, untuk memadatkan media di dalamnya. Uap air yang mungkin mengembun pada permukaan bagian dalam pelat dan tutup diuapkan dengan menjaga pelat dan tutup dalam posisi terbalik di dalam inkubator pada suhu 37°C selama kurang lebih 1 jam.
- Pengambilan sampel cairan (diduga mengandung bakteri, misalnya air kolam). Satu ml masing-masing sampel dipipet secara aseptik ke dalam 2 tabung kaldu (Gambar 6.2). Tabung diaduk. Sampel cairan juga dipipet secara aseptik ke dalam 2 cawan agar, masing-masing 0,1 ml, dan disebarkan pada permukaan media agar menggunakan penyebar kaca yang disterilkan dengan api.
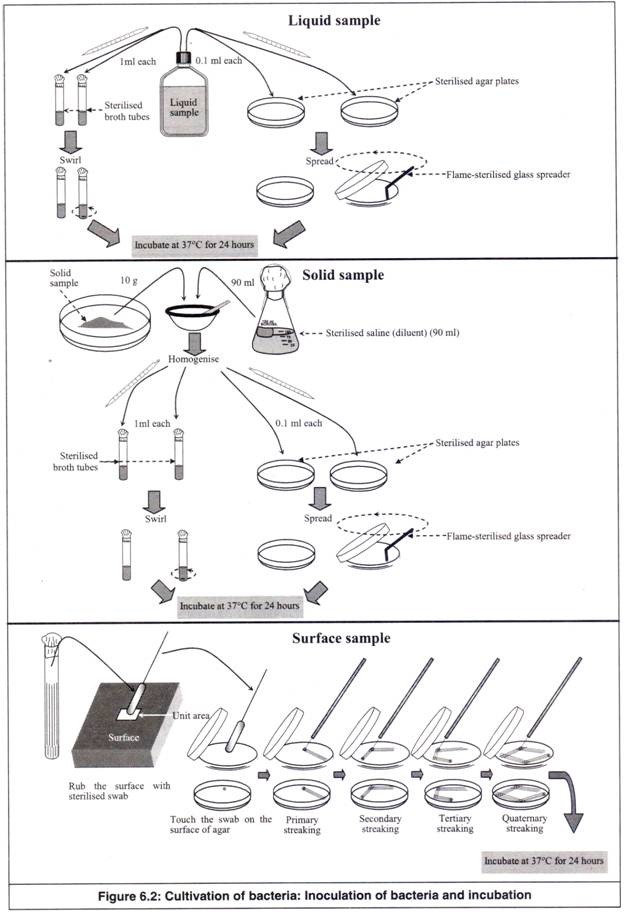
Sebelum masing-masing disebarkan dengan penyebar kaca, dicelupkan ke dalam alkohol dan dinyalakan di atas pembakar bunsen. Tabung dan pelat kaldu yang telah diinokulasi diinkubasi pada suhu 37°C selama 24 jam dalam inkubator. Pelat diinkubasi dalam posisi terbalik, dari atas ke bawah.
- Untuk sampel padat (misalnya tanah), 10g sampel ditimbang secara aseptis dan dihomogenkan dalam alu dan mortar steril atau cangkir homogeniser setelah menambahkan 90 ml garam steril dari labu berbentuk kerucut 100 ml.
Suspensi bakteri homogen ini dipipet secara aseptis ke dalam 2 tabung broth dan 2 agar plate seperti pada langkah 11 dan diinkubasi pada suhu 37°C selama 24 jam dalam inkubator (Gambar 6.2). Pelat diinkubasi dalam posisi terbalik, dari atas ke bawah.
- Untuk pengambilan sampel permukaan, permukaan yang diduga mengandung bakteri (bagian atas meja, permukaan tubuh, luka) diberi tanda satuan luas (misalnya 1 cm 2 ), yang digosok dengan swab steril. Usap disentuhkan ke permukaan dua pelat agar yang ditinggalkan.
Streaking dilakukan secara aseptis dengan loop yang disterilkan dengan api. Untuk goresan, garis yang hampir sejajar ditarik oleh lingkaran dari titik sentuh swab. Ini membentuk garis-garis utama. Setelah loop disterilkan dengan api, coretan sekunder ditarik hampir secara diagonal ke coretan primer. Dengan cara yang sama, goresan tersier dan kuaterner dibuat secara aseptik.
- Kemudian cawan diinkubasi dengan posisi terbalik, atas ke bawah, pada suhu 37°C selama 24 jam di dalam inkubator (Gambar 6.2).
- Satu piring agar yang tidak diinokulasi dan satu tabung kaldu yang tidak diinokulasi diinkubasi sebagai kontrol untuk memastikan sterilisasi yang tepat seperti yang ditunjukkan oleh tidak adanya pertumbuhan di dalamnya. Langkah ini opsional.
Pengamatan (Karakteristik Budaya):
Budaya Kaldu:
(i) Kekeruhan Teramati:
Pertumbuhan telah terjadi. Diamati ciri-ciri pertumbuhannya sebagai berikut (Gambar 6.3).
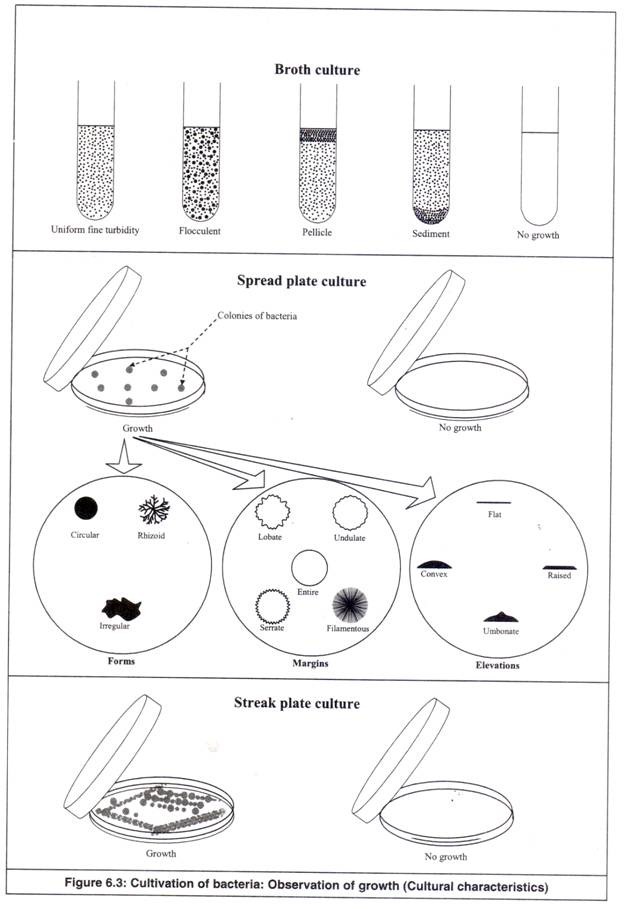
(sebuah) Kekeruhan Halus Seragam: Pertumbuhan tersebar halus di seluruh.
(b) Flokulan: Agregat serpihan tersebar di seluruh.
(c) Pelikel: Pertumbuhan seperti bantalan tebal di permukaan.
(d) Sedimen: Konsentrasi pertumbuhan di dasar biakan kaldu; mungkin granular, bersisik atau flokulan.
(ii) Tanpa Kekeruhan:
Tidak ada pertumbuhan yang terjadi. Sampel yang digunakan bebas bakteri.
2. Sebarkan Budaya Piring:
(i) Koloni yang Teramati:
Pertumbuhan telah terjadi. Diamati ciri-ciri koloni sebagai berikut (Gambar 6.3).
- Ukuran: Pinpoint, kecil, sedang atau besar.
- Pigmentasi: Warna koloni.
- Bentuk : Bentuk koloni digambarkan sebagai berikut :
(sebuah) Edaran: Tepi periferal yang tidak terputus.
(b) Irregular: Tepi periferal berlekuk.
(c) Rhizoid: Pertumbuhan menyebar seperti akar.
- Batas:
Penampakan tepi luar koloni digambarkan sebagai berikut:
(sebuah) Seluruh: Didefinisikan dengan tajam, rata.
(b) Lobate: Lekukan yang ditandai.
(c) Undulate: lekukan bergelombang.
(d) Serrate: Penampilan seperti gigi.
(e) Filamentous: Ujung menyebar seperti benang.
- Ketinggian:
Sejauh mana koloni dinaikkan digambarkan sebagai berikut:
(a) Datar: Ketinggian tidak terlihat.
(b) Ditinggikan: Sedikit ditinggikan.
(c) Cembung: elevasi berbentuk kubah.
(d) Umbonate: Dibesarkan dengan daerah tengah cembung yang ditinggikan.
(ii) Tanpa Koloni:
Tidak ada pertumbuhan yang terjadi di piring. Sampel yang digunakan bebas bakteri.
3. Budaya Streak Plate:
(i) Koloni yang Teramati:
Pertumbuhan telah terjadi. Hal ini diamati untuk karakteristik koloni seperti dijelaskan di atas.
(ii) Tanpa Koloni:
Tidak ada pertumbuhan yang terjadi: Sampel permukaan yang digunakan bebas bakteri.



