Artikel ini menyoroti proses pengurangan hidrogen sulfida. Proses pengurangan tersebut adalah: 1. Proses Kering dan 2. Proses Basah.
Proses Pengurangan # 1. Proses Kering:
Proses kering untuk menghilangkan H 2 S dari limbah gas dilakukan dengan mereaksikan H 2 S dengan oksida besi aktif. Produk reaksinya adalah besi sulfida.
Fe 2 O 3 + 3 H 2 S —–> Fe 2 S 3 + 3 H 2 O ……………..(5.51)
Proses dapat dilakukan baik dalam reaktor unggun tetap atau reaktor unggun terfluidisasi.
A. Proses Ranjang Tetap:
Prosesnya dilakukan dalam dua tahap. Selama tahap pertama gas sarat H2S dilewatkan pada temperatur sekitar melalui unggun yang mengandung oksida besi reaktif (bentuk a dan y) dicampur dengan beberapa bahan berserat atau butiran yang dibasahi dengan sekitar 40% air.
Ketika sebagian besar oksida besi telah diubah menjadi sulfida, aliran gas limbah dimatikan dan operasi tahap kedua dimulai. Selama tahap ini, udara pada suhu sekitar dilewatkan melalui unggun, yang menghasilkan regenerasi oksida besi dan pembebasan unsur belerang menurut reaksi di bawah ini:
2 Fe 2 S 3 + 3 O 2 —–> 2 Fe 2 O 3 + 6S ……………..(5.52)
Unsur belerang yang dibebaskan dapat diperoleh kembali dengan ekstraksi pelarut. Untuk kelancaran proses ini setidaknya diperlukan dua unggun, sehingga ketika di satu unggun terjadi reaksi pengurangan, unggun lain diregenerasi.
B. Proses Fluidized Bed:
Dalam set-up ini diperlukan dua unggun fluidisasi yang bersirkulasi. Pada unggun pertama H 2 S bereaksi dengan granula terfluidisasi dari oksida besi aktif pada suhu sekitar 340-360 °C. Dari unggun ini granula yang mengandung ferri sulfida dan ferri oksida yang tidak bereaksi mengalir ke unggun kedua dimana partikel sulfida dipanggang pada suhu sekitar 800 °C untuk meregenerasi ferri oksida dan memulihkan S sebagai SO 2 . Partikel oksida besi dikembalikan ke lapisan pertama dan SO 2 dikirim ke pabrik asam.
Proses Pengurangan # 2. Proses Basah:
Ada banyak proses basah untuk menghilangkan H2S dari limbah gas. Beberapa dari proses ini diuraikan di bawah ini.
A. Proses Girbotol:
Proses ini terdiri dari penyerapan H 2 S dalam larutan amina dan kemudian melepaskan H 2 S terlarut dengan uap. Amina yang akan digunakan dalam situasi tertentu tergantung pada apakah gas buang mengandung COS dan/atau CO 2 selain H 2 S.
Larutan berair amina monoetanol 15-20% dapat digunakan jika gas yang akan digosok tidak mengandung COS, karena COS membentuk urea dietanol yang stabil terhadap panas. Karena amina mono-etanol memiliki tekanan uap yang tinggi, H2S yang dihasilkan kembali dengan pemanasan uap tidak langsung dari larutan yang diresapi harus digosok untuk mendapatkan kembali amina yang tertahan.
Penggosokan dapat dilakukan dengan air, tetapi jika H 2 S akan diperoleh kembali sebagai gas kering, maka di-etilen glikol atau tri-etilena glikol harus digunakan sebagai cairan penggosok daripada larutan amina mono-etanol. Karena monoetanol amina juga menyerap CO 2 , itu bukan penyerap yang cocok dengan adanya CO 2 .
Di-ethanol amine adalah penyerap yang lebih baik daripada mono-ethanol amine karena tekanan uapnya lebih rendah daripada mono-ethanol amine. Di-etanol amina dapat digunakan bahkan ketika COS hadir bersama dengan H2S , karena COS tidak membentuk urea di-etanol. Jika limbah gas yang akan digosok mengandung H 2 S dan CO 2 , larutan tri-etanol amina atau metil-di-etanol amina 30% harus digunakan untuk penyerapan selektif H 2 S.
B. Proses Kalium Fosfat:
Ketika CO 2 hadir bersama dengan H 2 S, larutan kalium fosfat 40% dapat digunakan sebagai penyerap. Larutan ini menyerap H 2 S secara istimewa. Dari larutan yang diresapi H 2 S dilucuti dengan uap hidup.
C. Proses Natrium Karbonat:
Ketika H 2 S tidak disertai dengan CO 2 , 3 sampai 3,5% berair dari Na 2 CO 3 dapat digunakan sebagai penyerap.
Selama penyerapan natrium hidrogen sulfida dan natrium bikarbonat terbentuk:
Na 2 CO 3 + H 2 S Na HCO 3 + Na HS ……………..(5.53)
Untuk regenerasi karbonat dan pemulihan H2S , larutan bekas harus dilucuti dengan uap di bawah vakum. Metode alternatif untuk regenerasi larutan bekas adalah dengan mengoksidasinya dengan oksigen dengan adanya sekitar 0,5 persen oksida besi dalam suspensi dimana Na 2 CO 3 diregenerasi dan unsur belerang diendapkan.
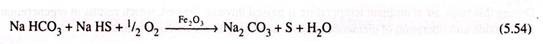
Proses alternatif (ketika CO 2 hadir bersama dengan H 2 S) adalah menggunakan larutan amonium karbonat untuk penyerapan daripada larutan natrium karbonat. Untuk regenerasi oksidasi larutan bekas dilakukan dengan oksigen dengan adanya Fe 2 O 3 . Proses alternatif lain (proses Thylox) menggunakan larutan natrium tioarsenat sebagai penyerap. Dalam proses ini untuk reaksi oksidasi-regenerasi tidak diperlukan katalis.
Reaksi dapat direpresentasikan sebagai di bawah:
Reaksi Penyerapan :
Na 4 As 2 S 5 O 2 + H 2 S —–>Na 4 As 2 S 6 O + H 2 O ……………..(5.55)
Reaksi Regenerasi :
Na 4 Sebagai 2 S 6 O + ½ O 2 —–>Na 4 Sebagai 2 S 5 O 2 + S ……………..(5.56)
D. Proses Stretford:
Proses Stretford adalah proses selektif H 2 S. Ini dapat mengurangi kandungan H2S sisa dalam gas yang diolah ke tingkat yang sangat rendah. Temperatur pengoperasian relatif rendah, sekitar 40 °C. Penyerap yang digunakan dalam proses ini untuk menghilangkan H2S adalah cairan alkali berair yang mengandung natrium karbonat, bikarbonat, vanadat dan garam natrium dari asam antrakuinon disulfonat (ADA) yang memiliki pH dalam kisaran 8,5 sampai 9,5.
Gas yang akan diolah digosok berlawanan arah dengan larutan dalam penyerap di mana hampir sebagian besar H2S dihilangkan . Kandungan residu H2S mungkin kurang dari 1 ppm .
Dari penyerap larutan mengalir ke oksidator (tangki reaksi) di mana regenerasi penyerap dan pembentukan unsur belerang terjadi karena pencampuran yang erat dengan udara.
Unsur belerang yang dihasilkan dalam pengoksidasi dipisahkan dengan pengapungan dan dihilangkan sebagai buih yang memiliki berat sekitar 10% padatan. Larutan regenerasi setelah penghilangan belerang dipompa kembali ke penyerap.
E. Proses LO-CAT:
Proses ini diklaim sebagai proses yang paling sesuai untuk menghilangkan H2S jika ada dalam tingkat ppm dalam aliran gas buang. Telah dikembangkan untuk menghilangkan masalah bau karena adanya H 2 S. Ini adalah proses reduksi-oksidasi fasa cair yang menghasilkan konversi H 2 S menjadi unsur belerang.
Cairan scrubbing adalah larutan encer organik-chelated besi encer. Besi mengoksidasi H 2 S sementara besi itu sendiri tereduksi. Larutan bekas dari scrubber kemudian dioksidasi dengan udara dimana penyerap diregenerasi untuk digunakan kembali dan unsur belerang dihasilkan.
Proses ini spesifik untuk H 2 S. Itu tidak menghilangkan senyawa bantalan belerang lainnya seperti COS, CS 2 , merkaptan. Ini dapat mengurangi H 2 S ke tingkat yang sangat rendah dalam gas yang diolah. Ini lebih unggul dari proses oksidasi-reduksi lainnya karena aktivitas katalitiknya yang lebih tinggi dan non-toksisitas.
Dari berbagai proses pengurangan H2S yang tersedia saat ini , yang satu ini ditemukan sangat ekonomis khususnya untuk pengolahan aliran gas besar yang memiliki kandungan H2S rendah .
F. Proses Cataban:
Agen katalitik yang digunakan dalam proses ini adalah larutan berair yang mengandung 2-4% besi besi terkelat. Kelat dapat digunakan pada rentang pH 1,0 hingga 11,0 yang luas dan rentang suhu dari bawah sekitar hingga sekitar 130 °C karena stabil pada rentang yang disebutkan di atas. Selama proses ion besi mengoksidasi H 2 S menjadi unsur belerang dan direduksi menjadi ion besi. Oksidasi udara secara bersamaan dari ion besi menjadi ion besi terjadi.
Reaksi dapat direpresentasikan sebagai:
2 Fe 3+ + H 2 S —–>2 Fe 2+ + S + 2 H + ……………..(5.57)
2 Fe 2+ + ½O 2 + H 2 O —–> 2 Fe 3+ + 2 OH – ……………..(5.58)
Proses ini dapat digunakan khususnya untuk pengurangan H2S pada konsentrasi rendah jika tujuannya bukan untuk memperoleh kembali belerang. Ketika aliran gas influen mengandung oksigen, tidak diperlukan aerasi untuk oksidasi ion besi.
G. Proses Giammarco-Vetrocoke:
Larutan kalium karbonat yang mengandung kalium arsenat digunakan untuk penyerapan H 2 S dalam Proses Giammarco-Vetrocoke. Ini digunakan untuk menghilangkan H 2 S dari gas coke-oven, gas sintesis serta gas alam. Kandungan H2S dari gas yang diolah mungkin serendah 1 ppm bahkan dengan adanya CO2 pada konsentrasi tinggi dan suhu operasi mendekati 150 °C.
Untuk regenerasi cairan bekas dioksidasi dengan O 2 (udara). Unsur belerang diproduksi sebagai produk akhir.
Reaksi kimia yang terjadi selama proses penyerapan-regenerasi dapat diringkas sebagai berikut:
KH 2 AsO 3 + 3H 2 S -> KH 2 As S 3 + 3 H 2 O ……………..(5.59)
KH 2 Sebagai S 3 + 3 KH 2 Sebagai O 4 —–>3 KH 2 Sebagai O 3 S + KH 2 Sebagai O 3 ……………..(5.60)
3 KH 2 Sebagai O 3 S —–>3 KH 2 Sebagai O 3 +3 S ……………..(5.61)
3 KH 2 Sebagai O 3 + 1 ½ O 2 —–> 3 KH 2 Sebagai O 4 ……………..(5.62)
Mekanisme dan langkah-langkah reaksi sebenarnya kompleks dan reaksi keseluruhan dapat dinyatakan sebagai
3H 2 S+1 ½ O 2 —–>3 S + 3 H 2 O ……………..(5.63)
Peran karbonat adalah untuk mempertahankan pH yang tepat.



