Artikel ini menyoroti dua proses pengurangan sulfur dioksida. Proses pengurangan tersebut adalah: 1. Proses Kering dan 2. Proses Basah.
Proses Pengurangan # 1. Proses Kering:
Dalam proses ini SO 2 yang mengandung limbah gas diolah dengan bahan kimia tanpa adanya air.
Proses Pembuangan Kering—Proses Batu Kapur/Dolomit:
Dalam proses ini batu kapur atau bubuk dolomit disuntikkan ke dalam ruang pembakaran dimana partikel dan aliran gas buang berlawanan arah. Pada suhu tungku yang tinggi, kalsium/magnesium karbonat terurai menjadi oksida yang pada gilirannya bereaksi dengan SO2 yang ada dalam gas buang membentuk sulfit dan sulfat. Reaksi keseluruhan dapat dinyatakan sebagai
2 CaCO 3 + 2 SO 2 + ½O 2 CaSO 3 + CaSO 4 + 2 CO 2 ….. ……………………†¦â€¦.(5.1)
2 MgCO 3 + 2 SO 2 + ½O 2 –> MgSO 3 + MgSO 4 + 2 CO 2 ……………………….( 5.2)
Sulfit dan sulfat yang dihasilkan bersama dengan CaO/MgO yang tidak bereaksi dikeluarkan dari tanur, dan dibuang. Karena kontak yang tidak cukup antara CaO/MgO dan gas cerobong dalam kebanyakan kasus, efisiensi penyisihan SO2 menjadi rendah meskipun faktanya karbonat ditambahkan dalam jumlah besar melebihi proporsi stoikiometri.
Beberapa data kinerja tipikal adalah:
Proses Dolomit:
Ukuran partikel optimal: 10-15 µm
Penambahan dolomit optimal: 2,5 kali jumlah stoikiometri.
Efisiensi penghapusan:
70 % dengan 250 ppm SO2
85% dengan 130 ppm SO2
Proses Batu Kapur :
Penambahan batu kapur optimal: 10% dari batubara yang dipecat
: 40-80% dengan 550-890 ppm SO2
Efisiensi penyisihan yang lebih tinggi dapat dicapai bila batu kapur/dolomit digunakan dalam ruang bakar batubara fluidized bed.
Meskipun proses kering berbahan dasar batugamping/dolomit kurang efisien dibandingkan dengan proses basah bubur kapur/batugamping, proses ini memiliki keuntungan sebagai berikut:
(i) Gas buang dapat diolah pada suhu tinggi,
(ii) Tidak diperlukan unit perawatan kompleks.
Proses kering ini memiliki keunggulan dibandingkan proses pemulihan kering karena mengalami kehilangan penyerap yang berlebihan karena gesekan dan biaya investasi yang tinggi karena kerumitan unit regenerasi.
Proses Pemulihan Kering:
- Proses Oksida Logam:
(i) Proses Oksida Mangan Aktif:
Proses ini dikembangkan oleh Mitsubishi Heavy Industries. Ini terdiri dari langkah-langkah berikut:
Langkah-I:
Oksida mangan yang terhidrasi dikontakkan dengan gas cerobong yang mengandung SO2 secara bersamaan sebagai hasil dari mangan sulfat yang dihasilkan.
Mn 2 O 3 + 2 SO 2 + ½ O 2 -> 2 MnSO 4 …………………………… ……(5.3)
Langkah-ll:
Mangan sulfat yang dihasilkan direaksikan dalam bejana terpisah dengan amonia cair dan udara dimana amonium sulfat diproduksi dan mangan oksida diendapkan.
2MnSO 4 + 4 NH 4 OH + ½ O 2 –> 2 (NH4) 2 SO 4 + Mn 2 O 3 + 2 H 2 O ……………… …………………(5.4)
Langkah-Ill:
Bubur yang dihasilkan disaring. Oksida mangan dikeringkan dan didaur ulang. Larutan amonium sulfat dipekatkan dan kristal amonium sulfat yang dihasilkan dipasarkan.
SO2 dari proses ini mungkin sekitar 90%.
(ii) Proses Tembaga Oksida :
Dalam proses ini pelet tembaga oksida yang didukung alumina bereaksi dengan SO 2 dan O 2 yang ada dalam gas buang untuk menghasilkan CuSO 4 pada suhu sekitar 400°C

Selanjutnya CuSO4 direduksi dengan hidrogen atau metana sekitar 400 °C, reaksinya adalah

Penggunaan metana dapat menyebabkan pengendapan kokas dan akibatnya penyumbatan lapisan.
Pada langkah selanjutnya tembaga dioksidasi dengan udara dan reaktor dihidupkan.
SO 2 yang dihasilkan dapat diubah menjadi asam sulfat atau unsur belerang.
Karena proses beroperasi dalam satu siklus, setidaknya diperlukan dua reaktor.
Prosesnya tampaknya menjanjikan. Namun, itu membutuhkan reaktor yang mahal dan pasokan gas pereduksi (H 2 /CH 4 ) yang besar.
(iii) Proses Alumina Alkalisasi:
Proses ini dilakukan dengan mengontakkan pelet aluminium natrium oksida counter saat ini sekitar 1,60 mm dengan gas buang bantalan SO 2 pada suhu sekitar 330 °C yang menghasilkan pembentukan alumino-natrium sulfat.
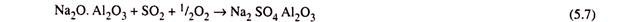
Pelet alumino-natrium sulfat kemudian direduksi di menara lain secara berlawanan dengan H-, dan CO pada suhu sekitar 650 °C untuk meregenerasi aluminium natrium oksida dan menghasilkan H2S . H2S yang dihasilkan kemudian diolah untuk pemulihan belerang .
Proses ini mungkin memiliki efisiensi penyisihan SO2 sekitar 90%. Namun, masalah utama yang dihadapi dalam proses ini adalah gesekan pelet yang mengakibatkan kerugiannya. Kerugian ini berdampak buruk pada ekonomi proses. Itu belum menemukan aplikasi komersial.
- Proses Karbon Aktif:
(i) Proses Reinluft:
Proses ini dilakukan dalam dua tahap. Pada tahap pertama gas buang yang mengandung SO 2 diadsorpsi pada unggun partikel karbon aktif yang bergerak pada suhu sekitar 150-200°C. Penyerap dioperasikan berlawanan arah. Partikel karbon aktif yang digunakan dalam proses ini dihasilkan oleh karbonisasi vakum dari gambut atau bahan serupa. Kunci potensi ekonomi dari proses ini terletak pada ketersediaan adsorben berbiaya rendah.
Selama proses adsorpsi, reaksi berikut terjadi pada permukaan adsorben:

Pada tahap kedua partikel karbon yang dimuat dengan asam sulfat yang keluar dari penyerap diperlakukan untuk pemulihan H 2 SO 4 seperti atau SO 2 . Partikel karbon yang diregenerasi didaur ulang kembali ke penyerap.
Ada dua proses alternatif untuk pemulihan senyawa bantalan belerang dari partikel karbon yang dimuat:
(a) Cuci partikel karbon dengan air. Ini menghasilkan produksi larutan asam sulfat encer. Partikel karbon basah dikeringkan dan didaur ulang kembali. Kelemahan dari proses ini adalah kesulitan yang dihadapi dalam penyimpanan, pengangkutan dan pemasaran larutan asam sulfat encer.
(b) Panaskan partikel karbon bermuatan asam sulfat hingga sekitar 380-450 °C. Pada pemanasan SO 2 , CO 2 , CO dan H 2 O dihasilkan dan partikel karbon diaktifkan kembali. Gas yang dihasilkan mengandung sekitar 10-15% SO 2 yang dapat dimanfaatkan untuk menghasilkan asam sulfat. Partikel karbon yang diregenerasi didaur ulang ke adsorber.
Efisiensi penyisihan proses Reinluft adalah sekitar 90%.
(ii) Proses Westvaco :
Proses Westvaco mempekerjakan partikel karbon aktif di tempat tidur yang bergerak. Produk antara yang terbentuk selama proses tersebut adalah asam sulfat tetapi akhirnya belerang diperoleh kembali sebagai unsur belerang.
Proses tersebut dilakukan melalui langkah-langkah berikut.
Langkah-I:
SO 2 ,O 2 dan uap air yang ada dalam gas buang bergabung pada partikel karbon aktif untuk menghasilkan asam sulfat.

Langkah-ll:
Asam sulfat yang terserap direaksikan dengan H,S untuk menghasilkan unsur sulfur pada permukaan partikel karbon.

Langkah-Ill:
Partikel karbon yang mengandung unsur partikel belerang dipanaskan untuk menghasilkan uap belerang, yang terkondensasi dan terkumpul sebagai belerang cair.
Langkah-IV:
Sisa belerang yang ada pada partikel karbon diubah menjadi H 2 S dengan mereaksikannya dengan hidrogen (H 2 ) dan dengan demikian mengaktifkan kembali partikel karbon. H2S yang dihasilkan digunakan pada Langkah II dan partikel karbon digunakan kembali. Proses ini telah dioperasikan pada skala percontohan. Efisiensi penyisihan SO2 yang dilaporkan adalah 90%. Telah diklaim bahwa efisiensi penghilangan 99% dapat dicapai dengan menggunakan lapisan karbon yang lebih dalam.
Kelemahan dari proses tersebut adalah:
(i) Ukuran bejana yang diperlukan untuk menampung partikel karbon adalah besar dan penurunan tekanan melintasi unggun tinggi;
(ii) Jumlah hidrogen yang dibutuhkan untuk menghilangkan sisa belerang (Langkah IV) jauh lebih tinggi daripada jumlah stoikiometri.
- Proses Karbonat Cair:
Atomics International Molten Carbonate Process menggunakan lelehan eutektik yang mengandung 32% Li 2 CO 3 , 33% Na 2 CO 3 dan 35% K 2 CO 3 menurut beratnya untuk menyerap SO 2 dari gas buang pada sekitar 450 °C. Efisiensi penyisihan SO2 dari proses ini telah ditemukan sekitar 99% dari gas influen yang memiliki 0,1 sampai 3% SO2 .
Reaksi dapat dinyatakan seperti di bawah ini:
SO 2 + M 2 CO 3 —–>M 2 SO 3 + CO 2 ……………………(5.11)
SO 2 + ½ O, + M 2 CO 3 —–>M 2 SO 4 + CO 2 …………….(5.12)
Lelehan yang dimuat kemudian dikurangi dengan campuran H, dan CO dimana aliran gas yang mengandung H2S , CO, dan H2O diproduksi bersama dengan karbonat regenerasi. Proses regenerasi dilakukan pada suhu sekitar 525°C. Proses alternatif adalah mereduksi sulfit—sulfat yang meleleh menjadi sulfida dengan karbon dan udara pada suhu sekitar 750 °C. Lelehan sulfida-karbonat selanjutnya direaksikan dengan uap dan CO 2 pada suhu sekitar 450 °C yang menghasilkan pembentukan H 2 S dan lelehan karbonat.
H2S yang dihasilkan dapat digunakan baik untuk produksi asam sulfat atau untuk produksi unsur belerang. Meskipun pengoperasian unit terintegrasi lengkap yang menggunakan proses ini belum dilakukan, prosesnya menarik karena teknologi unik yang terlibat. Proses ini dapat digunakan untuk pemulihan belerang dari gas cerobong bebas debu.
Proses Pengurangan # 2. Proses Basah:
ini dilakukan dengan menggosok gas buang yang mengandung SO2 baik dengan sluri berair atau dengan larutan berair.
Proses Pembuangan Basah:
- Proses Berbasis Kapur/Batu Kapur:
(i) Proses Konvensional:
Dalam proses ini aliran gas cerobong yang dibebaskan dari bahan partikulat digosok dengan suspensi encer bubuk kapur/batu kapur yang memiliki 5-10% berat padat. SO 2 , efisiensi penyisihan dari proses ini adalah sekitar 80 sampai 95%.
Meskipun batu kapur jauh lebih murah daripada kapur, untuk beberapa aplikasi kapur lebih disukai karena reaktivitasnya yang lebih tinggi. Gas yang digosok dipanaskan kembali sebelum dibuang ke atmosfer melalui tumpukan.
Suspensi bekas dari dasar scrubber dimasukkan ke dalam tangki resirkulasi dari mana sebagian diumpankan kembali ke scrubber dengan air make-up dan bubuk kapur/batu kapur yang baru ditambahkan. Bagian yang tersisa dibuang ke kolam pengendapan. Lumpur yang mengendap dari kolam dibuang dan cairan supernatan disirkulasikan kembali ke scrubber bersama dengan suspensi berair. Dalam scrubber terutama diproduksi bi-sulfit dan bi-sulfat. Ini mengalami reaksi lebih lanjut dalam tangki resirkulasi / penundaan.
Reaksi yang terjadi pada scrubber adalah:
2CaCO 3 + 4 SO 2 + O 2 + 2 H 2 O –> Ca (HSO 3 ) 2 + Ca (HSO 4 ) 2 + 2 CO 2 …….(5.13)
2 Ca (OH) 2 + 4 SO 2 + O 2 –> Ca (H SO 3 ) 2 + Ca (H SO 4 ) 2 ………………†¦(5.14)
Dalam tangki resirkulasi/penundaan, reaksi yang terjadi dapat diringkas sebagai berikut:
CaCO 3 + Ca (HSO 3 ) 2 –>2 Ca SO 3 + H 2 O + CO 2 …………..(5.15)
CaCO 3 + Ca (HSO 4 ) 2 –>2 Ca SO 4 + H 2 O + CO 2 …………..(5.16)
Ca (OH) 2 + Ca (HSO 3 ) 2 –>2 Ca SO 3 + 2H 2 O ……………….(5.17)
Ca (OH) 2 + Ca (HSO4) 2 –>2 Ca SO 4 + 2 H 2 O ………………(5.18)
Batu kapur kelas kimia yang mengandung 95% atau lebih CaCO 3 paling cocok untuk proses ini. Dolomit yang relatif lembam tidak cocok untuk proses ini. Untuk proses berbasis batugamping rasio massa L/G harus melebihi 65 tetapi untuk proses berbasis kapur rasio massa L/G sekitar 35 sudah cukup. Untuk penyisihan rasio kapur terhadap SO2 yang dibutuhkan adalah sekitar 1,05-1,15 kali proporsi stoikiometrik karena reaktivitasnya yang lebih tinggi sedangkan untuk batugamping rasio yang dibutuhkan adalah sekitar 1,25 hingga 1,6.
Batu kapur lebih murah dibandingkan dengan kapur, tetapi ukuran scrubber berbahan dasar batu kapur akan lebih besar daripada scrubber berbahan dasar kapur karena rasio L/G yang lebih tinggi untuk yang pertama. Untuk instalasi besar proses kapur akan lebih ekonomis, sedangkan untuk instalasi kecil proses kapur akan lebih ekonomis
Mengoperasikan scrubber pada pH rendah (pH tidak kurang dari 5) meningkatkan pembentukan kerak kalsium sulfat yang keras (dalam scrubber dan sistem resirkulasi), sedangkan pengoperasian pada pH yang lebih tinggi (pH scrubber influen melebihi 8) mendorong pembentukan partikel kalsium sulfit lunak .
PH optimum untuk sistem kapur adalah antara 5,8 dan 6. Untuk sistem kapur, pH yang sedikit asam adalah yang paling cocok. Reaksi antara kapur dan CO 2 dalam gas buang menyebabkan pengendapan CaCO 3 di atas pH 6,7, yang mengakibatkan konsumsi kapur lebih tinggi. Oleh karena itu pH untuk sistem kapur tidak boleh melebihi 6,7.
Waktu tinggal dalam tangki resirkulasi adalah sekitar 10 menit untuk sistem kapur dan waktu yang sama sekitar 5 menit untuk sistem kapur.
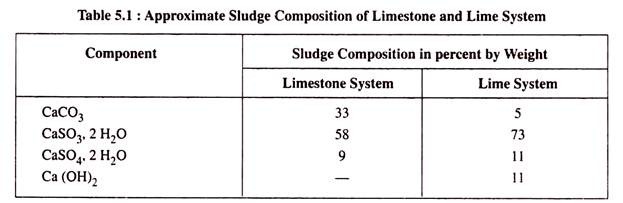
Perkiraan komposisi lumpur dari sistem batu kapur dan untuk sistem kapur tercantum dalam Tabel 5.1.
(ii) Chiyoda Thoroughbred 121 Proses :
Bubur kapur digunakan sebagai penyerap dalam proses ini. Namun berbeda dengan proses batugamping konvensional dalam tiga hal, yaitu (1) pH penyerap. (2) desain reaktor dan (3) pemasukan udara ke bagian bawah reaktor. Udara digunakan untuk oksidasi SO 2 , menjadi SO 3 .
PH dipertahankan dalam proses ini sekitar 4 sampai 5; akibatnya sulfit yang terbentuk teroksidasi menjadi sulfat. Prosesnya dilakukan dalam reaktor tunggal tipe khusus yang disebut reaktor gelembung jet. Karena proses tersebut menghasilkan gipsum sebagai produk akhir, tidak diperlukan daur ulang cairan.
Kelancaran operasi tanpa masalah dan efisiensi penyisihan SO 2 dalam kisaran 97-99% dengan konsentrasi gas buang SO 2 berkisar antara 1000-2000 ppm telah dilaporkan. Pemanfaatan batu kapur yang tinggi dan kandungan gipsum yang tinggi dari lumpur telah diamati.
Reaksi keseluruhan dapat diringkas sebagai berikut:
CaCO 3 + SO 2 + 1/2 O 2 + 2 H 2 O –>Ca SO 4 . 2H 2 O + CO 2 …………..(5.19)
(iii) Proses Alkali Ganda :
Dalam proses ini gas buang diperlakukan dengan larutan natrium sulfit, yang menyerap SO2 ,
Reaksi utama dapat dinyatakan sebagai berikut:
Na 2 SO 3 + SO 2 + H 2 O –>2 Na H SO 3 ………………..(5.20)
Bahan kimia lain yang ada dalam larutan bekas mungkin natrium sulfit, natrium sulfat dan natrium karbonat. Sebagian dari cairan bekas didaur ulang ke penyerap. Bagian lainnya diolah dengan kapur atau bubuk kapur.
Produk reaksinya adalah kalsium sulfit dan sulfat yang tidak larut, natrium sulfit (dan hidroksida) yang larut. Endapan menebal di pemukim. Lumpur disaring dan kue dicuci. Cairan bening dari operasi pengendapan dan filtrasi bersama dengan natrium karbonat make-up dikembalikan ke penyerap.
Dua studi biaya independen telah menunjukkan bahwa biaya pemasangan dan pengoperasian sistem alkali ganda lebih kecil daripada biaya sistem scrubbing bubur batu kapur untuk pengolahan gas cerobong bahan bakar belerang yang relatif tinggi.
(iv) Proses Asam Encer:
Proses ini merupakan alternatif dari proses alkali ganda. Dalam proses ini SO 2 diserap dalam larutan asam sulfat encer (2-3% H 2 SO 4 ) dengan besi sebagai katalis.
Reaksi yang terjadi adalah :
2 SO 2 + O 2 + 2 H 2 O –> 2 H 2 SO 4 ………………….. (5.21)
2 Fe SO 4 + SO 2 + O 2 –>Fe 2 (SO 4 ) 3 ………………..(5.22)
Fe 2 (SO 4 ) 3 + SO 2 + 2 H 2 O –> 2 Fe SO 4 + 2 H 2 SO 4 ………………..( 5.23)
Asam sulfat yang dihasilkan direaksikan dengan batu kapur untuk mengendapkan gipsum.
SO2 dari proses ini telah dilaporkan sekitar 90%.
- Proses Berbasis Logam Alkali :
Ini juga merupakan proses membuang di mana kapur atau batu kapur tidak digunakan secara langsung atau tidak langsung. Sangat cocok untuk pengolahan aliran gas buang yang relatif kecil yang mengandung SO2 . Alkali yang digunakan untuk scrubbing adalah sodium hidroksida atau karbonat.
Dalam proses ini aliran gas buang didinginkan terlebih dahulu dengan melewatkannya melalui venturi scrubber. Selanjutnya gas yang telah dibersihkan dan didinginkan digosok dengan larutan alkali dalam kolom baki ayakan tunggal. Akhirnya gas yang diolah dipanaskan kembali dengan menambahkan udara panas dan dibuang ke atmosfir melalui cerobong.
Scrubber venturi diumpankan dengan larutan daur ulang sedangkan kolom sieve tray diumpankan dengan larutan alkali baru.
Keuntungan dari proses ini adalah biaya modal yang rendah. Namun, total biaya operasi karena biaya bahan kimia dan biaya pembuangan minuman keras bekas lebih besar daripada biaya modal yang rendah. Efisiensi penyisihan SO2 yang dilaporkan dari proses ini adalah sekitar 85%
Proses Pemulihan Basah:
- Proses Oksida/Hidroksida Logam:
(i) Proses Magnesium Oksida :
Proses ini dilakukan dalam tiga langkah.
Langkah-I:
Pada langkah pertama aliran gas bantalan SO2 yang telah dibersihkan sebelumnya digosok dengan suspensi magnesia berair .
Reaksi yang dihasilkan adalah:
MgO + 2 SO 2 + H 2 O ——> Mg ( H SO 3 ) 2 ………………… (5.24)
Mg (HSO 3 ) 2 + MgO ——>2 Mg SO 3 + H 2 O …………….(5.25)
2 Mg SO3 + O2 ——>2 Mg SO4 â €¦â€¦â€¦â€¦â€¦â€¦â€¦â€¦ (5.26)
Langkah-ll:
Pada langkah ini sebagian bubur magnesium sulfit-sulfat bersama dengan magnesia yang tidak bereaksi didaur ulang ke scrubber yang dicampur dengan magnesia make-up dan air. Bagian lain dari bubur disaring dan kue dikeringkan.
Langkah-Ill :
Tahap ketiga cake kering dicampur dengan coke dan dikalsinasi dalam kiln dengan suhu sekitar 850-900 °C.
Selama kalsinasi, reaksi berikut terjadi:
Mg ( H SO 3 ) 2 ——> MgO + 2 SO 2 + H 2 O …………….(5.27)
Mg SO 3 ——> MgO + SO 2 ……………..(5.28)
Mg SO 4 + C + ½ O 2 ——> MgO + SO 2 + CO 2 ……………….(5.29)
MgO yang telah diregenerasi didaur ulang ke scrubber dan SO2 yang dihasilkan digunakan untuk produksi asam sulfat.
SO2 dari pabrik Craumby Unit 1 PECO telah dilaporkan sebesar 96-98%.
(ii) Proses Mitsubishi Manganese Oxy-hydroxide :
Proses ini dilakukan dengan menggosok gas limbah yang telah dibersihkan sebelumnya yang mengandung SO2 dengan bubur mangan oksi-hidroksida tiga persen dimana mangan sulfit dan sulfat diproduksi seperti ditunjukkan di bawah ini .
Mn (OH) 2 + SO 2 ——>MnSO 3 + H 2 O …………..(5.30)
Mn (OH) 2 + SO 2 + ½ O 2 ——>MnSO 4 + H 2 O ……………….(5.31)
Bubur dari outlet scrubber direaksikan dengan amonia dan oksigen yang menghasilkan pembentukan larutan amonium sulfat dan regenerasi partikel Mn(OH) 2 . Suspensi disaring untuk memisahkan Mn(OH) 2 , yang direcycle ke scrubber. Larutan amonium sulfat dipekatkan untuk mengkristal (NH 4 ) 2 SO 4 , yang dipasarkan.
Mn SO 3 + 2 NH 4 OH + ½ O 2 ——> Mn (OH) 2 + (NH 4 ) 2 SO 4 (5.32)
Mn SO 4 + 2 NH 4 OH ——> Mn (OH) 2 + (NH 4 ) 2 SO 4 (5.33)
SO2 dari proses ini mungkin sekitar 97%.
- Proses Karbon Aktif (Lurgi Sulphacid) :
Proses Lurgi Sulphacid dilakukan dengan melewatkan gas buang yang mengandung sekitar O,1 sampai 1,5 persen SO2 melalui lapisan karbon aktif. Lapisan karbon mengkatalisis oksidasi SO 2 menjadi SO 3 , yang bereaksi dengan air yang disemprotkan pada lapisan.
Larutan asam sulfat encer yang memiliki konsentrasi 10-15% H 2 SO 4 dihasilkan. Asam encer dipekatkan menjadi sekitar 60-70% dengan memanfaatkan panas gas yang masuk (190-210 °C) sehingga mendinginkan gas hingga 40-50 °C sebelum masuk ke lapisan karbon. Gas yang keluar dari lapisan karbon dipanaskan kembali sebelum dibuang ke cerobong.
Efisiensi penyisihan SO2 dari proses ini adalah sekitar 95%.
- Proses Sitrat:
Proses ini didasarkan pada fakta bahwa kelarutan SO2 dalam air rendah tetapi meningkat secara signifikan ketika air disangga dengan natrium sitrat. Reaksi dasar yang terjadi selama proses tersebut adalah:
SO 2 + H 2 O ——>H 2 SO 3 ………………..(5.34)
Selama penyerapan SO 2 dalam larutan buffer sitrat beberapa SO 2 dapat teroksidasi menjadi SO 3 yang pada gilirannya diubah menjadi H 2 SO 4 . Untuk menekan reaksi oksidasi tiosulfat ditambahkan ke larutan scrubbing. Larutan asam sulfat (H 2 SO 3 ) yang dihasilkan kemudian direaksikan dengan H 2 S, yang menghasilkan pembentukan unsur belerang. Unsur belerang dipisahkan dari larutan dengan pengapungan. Solusinya didaur ulang ke scrubber.
Proses ini dikembangkan oleh Pusat Penelitian Metalurgi Salt Lake City dari Biro Pertambangan AS untuk pemulihan SO2 dari gas pelebur. Uji coba skala pabrik percontohan selanjutnya dilakukan pada gas cerobong boiler berbahan bakar batubara. Hasil uji coba pada smelter dan gas cerobong boiler terbukti menjanjikan. Efisiensi penyisihan belerang telah dilaporkan 95-97%.
- Proses Sulfidin :
Proses sulfidin menggunakan campuran xylidine dan air dengan perbandingan sekitar 1:1 sebagai cairan penggosok. Xylidine dan air tidak bercampur tetapi ketika beberapa SO 2 bereaksi dengan xylidine sistem menjadi bercampur.
Proses ini dilakukan dalam satu set dua peredam yang beroperasi berlawanan arah secara seri. Gas bantalan SO2 bebas debu dimasukkan di bagian bawah penyerap pertama di mana aliran cairan yang meninggalkan penyerap kedua diumpankan . Gas yang meninggalkan penyerap pertama dimasukkan di bagian bawah penyerap kedua, yang digosok dengan campuran xylidine-air yang diperoleh kembali.
Gas yang digosok meninggalkan penyerap kedua selanjutnya digosok dengan asam sulfat encer untuk pemulihan uap xylidine sebelum akhirnya mengeluarkan gas yang diolah. Cairan yang meninggalkan penyerap pertama dilucuti secara termal secara tidak langsung untuk pemulihan SO2 . Gas dari stripper yang mengandung xylidine dan uap air selain SO 2 dilewatkan melalui kondensor pendingin untuk kondensasi xylidine dan air. Gas (terutama SO 2 ) selanjutnya digosok dengan air untuk pemulihan uap xylidine lebih lanjut.
Aliran cairan yang muncul dari stripper termal didinginkan dan dicampur dengan:
(1) Cairan dari pendingin-kondensor,
(2) Cairan dari kolom water-wash, dan
(3) Cairan dari scrubber asam sulfat encer.
Sebagian dari lapisan air dari campuran ini dibuang sehingga terdapat campuran xylidine-air yang mempunyai perbandingan 1:1 dalam aliran yang tersisa. Aliran ini diumpankan kembali ke penyerap kedua sebagai penyerap. Dari waktu ke waktu larutan soda abu encer ditambahkan ke aliran daur ulang sehingga xylidine sulfat yang ada di aliran diubah menjadi xylidine. Proses ini tidak ekonomis bila kandungan SO2 gas buang rendah karena hilangnya xylidine.
- Dimetil anilin (ASARCO) Proses :
Proses AS ARCO lebih baik dari pada proses Sulphidin dalam arti dapat mengolah gas buang yang memiliki kandungan SO2 3,5% atau lebih .
SO 2 pertama-tama digosok dengan dimetil anilin dan kemudian dengan larutan soda abu untuk menghilangkan jejak SO 2 dari gas yang diolah. Terakhir, gas buang digosok dengan asam sulfat encer untuk menghilangkan dimetil anilin sebelum membuangnya melalui tumpukan.
anilin yang kaya SO2 dipisahkan dengan uap untuk pemulihan SO2 . Campuran uap SO2 yang dihasilkan digosok dengan asam sulfat untuk memperoleh SO2 kering . SO2 yang diperoleh kembali , dapat dicairkan atau diubah menjadi asam sulfat. Hingga 99% pemulihan SO2 telah dilaporkan. Regenerasi dimetil anilin didaur ulang ke scrubber. Keuntungan dari proses ini dibandingkan proses Sulphidin adalah kehilangan reagen yang rendah, konsumsi uap yang rendah, dan kebutuhan tenaga kerja yang lebih sedikit.
- Proses Ammonia (COMINCO) :
Proses ini dilakukan dalam dua tahap. Pada tahap pertama SO 2 , dihilangkan dari gas limbah dari pabrik pemanggangan dengan menggosok dengan larutan amonia encer dimana amonium bi-sulfit dihasilkan:
NH 4 OH + SO 2 ——>NH 4 (HSO 3 ) ……………….(5.35)
Pada tahap kedua larutan bi-sulfit diperlakukan dengan asam sulfat. Campuran yang dihasilkan dilucuti udara. Larutan yang dilucuti udara mengandung amonium sulfat sedangkan aliran gas mengandung SO 2 , udara dan uap air.
2NH 4 (HSO3) + H 2 SO 4 ——>(NH 4 ) 2 SO 4 + 2 H 2 SO 3 ……………….. (5.36)
(NH 4 ) 2 SO 4 + 2H 2 SO 3 + udara ——> (NH 4 ) 2 SO 4 + 2 SO 2 + 2 H 2 O + udara …………..( 5.37)
Larutan amonium sulfat dipekatkan untuk menghasilkan kristal amonium sulfat. SO 2 – campuran gas udara setelah pengeringan digunakan untuk menghasilkan asam sulfat.
SO2 telah diamati bervariasi dari 85-97% .
Faktor utama yang menjadi dasar efisiensi penyisihan adalah:
(i) Tinggi tempat tidur yang dikemas,
(ii) Temperatur pengoperasian, dan
(iii) Rasio massa cairan terhadap gas (L/G) dalam penyerap.
- Proses Natrium Sulfit (Wellman-Lord) :
Awalnya proses ini didasarkan pada siklus kalium sulfit-bi-sulfit. Namun, saat ini garam natrium yang lebih murah sedang digunakan. Dalam proses ini aliran gas limbah yang mengandung SO 2 digosok dengan larutan natrium sulfit, yang menghasilkan pembentukan natrium bi-sulfit. Reaksi tersebut dapat diringkas sebagai
Na 2 SO 3 + SO 2 + H 2 O ——>2 NaHSO 3 ………….(5.38)
Larutan bi-sulfit yang terbentuk dipekatkan dalam evaporator sirkulasi paksa di bawah vakum. Larutan pekat kemudian mengalami pengupasan uap pada suhu yang lebih tinggi, yang menyebabkan dekomposisi bi-sulfit menjadi sulfit. Natrium sulfit sehingga dihasilkan mengkristal dari larutan. Reaksi dapat dinyatakan sebagai:
2 NaHSO 3 ——> Na 2 SO 3 + SO 2 + H 2 O ………..(5.39)
Na 2 SO 3 dipisahkan, dilarutkan dan larutan dikembalikan ke absorber. Gas SO2 yang lembab dikeringkan dan diumpankan ke pabrik asam sulfat.
Efisiensi penyisihan rata-rata SO2, telah diamati sekitar 91%.
- Proses Natrium Hidroksida :
Penggosokan gas buang yang mengandung SO 2 dengan larutan natrium hidroksida menghasilkan pembentukan bi-sulfit dan sulfit.
2 Na OH + CO 2 ——> Na 2 CO 3 + H 2 O ………………..(5.40)
Na 2 CO3 + SO 2 ——>Na 2 SO 3 + CO 2 ………………..(5.41)
Na 2 SO 3 + SO 2 + H 2 O ——> 2Na ( H SO 3 ) ………………..(5.42)
Na OH + SO 2 ——> NaH SO 3 ………………..(5.43)
Larutan natrium sulfit-bi-sulfit kemudian direaksikan dengan debu seng oksida (ZnO) dimana ZnSO 3 diendapkan dan larutan NaOH diregenerasi. Larutan NaOH didaur ulang ke absorber.
Endapan Zn SO 3 disangrai setelah dikeringkan.
Zn SO 3 ——>ZnO + SO 2 ………………..(5.44)
ZnO digunakan kembali dan SO 2 diumpankan ke pabrik asam sulfat.
- Proses Biologis :
Proses ini telah dikembangkan bersama oleh Monsanto Enviro-Chem System dan sistem UOP untuk pengolahan gas buang FCC yang mengandung N 2 ,O 2 , H 2 O , CO 2 , CO , SO x dan NO x bersama dengan beberapa partikel debu katalis. Kisaran konsentrasi SOx adalah 250-2300 ppm dan NOx sekitar 200 ppm dalam gas.
Prosesnya terdiri dari menggosok gas buang dalam scrubber basah reverse-jet dengan larutan NaHCO 3 . Reaksi utama yang terjadi selama scrubbing adalah
Na HCO 3 + SO 2 —–>Na H SO 3 + CO 2 ………………..(5.45)
Beberapa natrium bi-sulfit dapat teroksidasi menjadi Na 2 SO 4 karena adanya oksigen dalam gas yang sedang diolah. Campuran gas-cair yang mengandung beberapa partikel padat terpisah menjadi dua aliran dalam bejana yang berdampingan. Gas keluar di bagian atas bejana dan cairan mengalir ke bah. Cairan dari bah setelah filtrasi terutama didaur ulang ke scrubber sementara sebagian diumpankan ke bioreaktor anaerobik
Dalam bioreaktor, sulfit dan sulfat direduksi menjadi natrium bi-sulfida dengan persediaan terbatas dari zat pereduksi yang sesuai atau menjadi H2S jika digunakan zat pereduksi dalam jumlah yang lebih besar. Zat pereduksi dapat berupa gas hidrogen dengan kemurnian rendah atau etanol atau metanol. Etanol atau metanol dapat digunakan sebagai sumber karbon untuk mikroorganisme.
Pada reaktor anaerobik reaksi yang terjadi adalah:
(I) dengan pasokan terbatas agen pereduksi—
NaHSO 3 + 3 H 2 —–> NaHS + 3 H 2 O ………………..(5.46)
Na 2 SO 4 + 4 H 2 + CO 2 —–>NaHS + NaHCO 3 + 3 H 2 O ………………..(5.47)
(II) dengan suplai zat pereduksi yang lebih besar:
NaHSO 3 + 3 H 2 + CO 2 —–>NaHCO 3 + H 2 S + 2 H 2 O ………………..(5.48)
Na 2 SO 4 + 4 H 2 + 2 CO 2 —–>2 Na HCO 3 + H 2 S + 2 H 2 O ……………(5.49)
Ketika H 2 S dicampur dengan CO 2 dihasilkan, gas dialirkan ke penyerap amina atau beberapa unit pemulihan belerang lainnya. Cairan yang mengandung NaHCO 3 dari outlet reaktor anaerob didaur ulang ke absorber.
Namun, jika NaHS hadir dalam limbah reaktor anaerobik, ia diumpankan ke reaktor aerobik untuk regenerasi NaHCO 3 dan produksi unsur belerang sesuai dengan reaksi:
NaHS + ½ O 2 + CO 2 —–> NaHCO 3 + S ………………..(5.50)
Bubur yang mengandung unsur belerang disaring dan filtrat yang mengandung Na HCO 3 didaur ulang ke scrubber.
Efisiensi penyisihan belerang secara keseluruhan dari seluruh proses mungkin setinggi 98%.



