Uji Urease pada Bakteri untuk Mengetahui Kemampuannya Menghidrolisis Urea (Dengan Gambar)!
Prinsip:
Beberapa bakteri memiliki kemampuan untuk menghidrolisis (mengurai dengan adanya air) urea menjadi NH 3 dan CO 2 , karena mereka dapat menghasilkan enzim ‘urease’.
NH 3 bersifat basa (basa), karena itu meningkatkan pH mengubah warna fenol merah dari kuning menjadi merah muda.
Pada uji urease, bakteri uji ditumbuhkan pada agar miring yang mengandung urea dan fenol merah. Jika bakteri memiliki kemampuan untuk menghidrolisis urea, warna media akan berubah dari kuning menjadi merah muda. Beberapa bakteri dapat menghasilkan NH 3 dengan memecah pepton dalam medium. Dalam kasus seperti itu, hasil positif palsu diperoleh.
Bahan yang Dibutuhkan:
Tabung reaksi, labu berbentuk kerucut, sumbat kapas, jarum inokulasi, autoklaf, pembakar bunsen, ruang aliran laminar, tabung pembuangan, inkubator, alat filtrasi membran, agar urea, koloni terisolasi atau biakan murni bakteri.
Prosedur:
- Lima buah tabung reaksi disumbat dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang (Gambar 7.15).
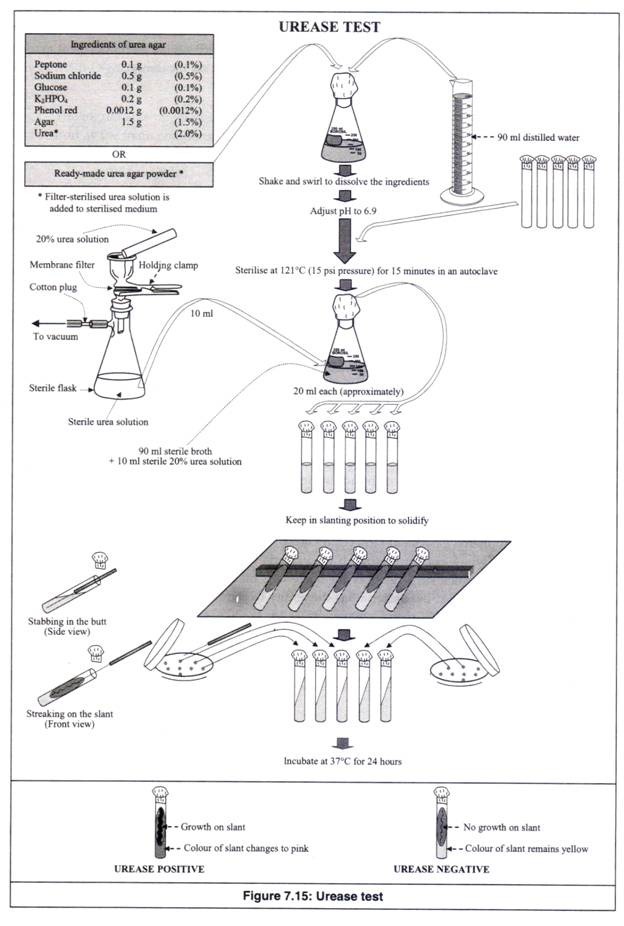
- Bahan media urea agar (mengandung urea sebagai komponen utama) atau bubuk siap pakai (kecuali urea) yang dibutuhkan untuk 100 ml media ditimbang dan dilarutkan dalam 90 ml air suling dalam labu berbentuk kerucut 250 ml dengan cara gemetar dan berputar-putar.
- Ditentukan pH-nya menggunakan kertas pH atau pH meter dan disesuaikan menjadi 6,9 menggunakan HCI 0,1N jika lebih atau menggunakan NaOH 0,1N jika kurang.
- Labu dipanaskan untuk melarutkan agar-agar dalam media secara sempurna.
- Labu ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Lima tabung reaksi dan labu berbentuk kerucut yang berisi urea agar (kecuali urea) disterilkan pada suhu 121°C (tekanan 15 psi) selama 15 menit dalam autoklaf.
- Setelah sterilisasi, mereka dikeluarkan dari autoklaf dan dibiarkan dingin beberapa saat tanpa membiarkan media memadat. Pendinginan media mencegah kondensasi dan akumulasi tetesan air pada bidang miring. Jika media telah disiapkan dan dipadatkan selama penyimpanan, maka harus dicairkan dengan cara dipanaskan secara hati-hati sampai benar-benar meleleh.
- Larutan urea 20% dibuat dengan melarutkan 20 gram urea dalam 100 ml air suling dan disterilkan dengan alat filtrasi membran, karena urea tidak dapat disterilkan dengan panas, karena akan terurai saat dipanaskan.
- 10 ml larutan urea steril dicampur secara menyeluruh dengan 90 ml media cair yang didinginkan dan disterilkan (dicairkan dengan pemanasan).
- Sebelum memadat, media, dalam kondisi cair hangat, didistribusikan secara aseptik ke dalam 5 tabung reaksi steril yang disumbat kapas (masing-masing sekitar 20 ml).
- Tabung reaksi disimpan dalam posisi miring untuk mendinginkan dan memadatkan media sehingga diperoleh urea agar miring.
- Bakteri uji diinokulasi secara aseptik, lebih disukai dalam ruang aliran laminar, ke dalam miring dengan menusuk ke pantat dan menggores permukaan miring dengan bantuan jarum yang disterilkan dengan api. Jarum disterilkan setelah setiap inokulasi.
- Slant yang telah diinokulasi diinkubasi pada suhu 37°C selama 24 jam dalam inkubator.
Pengamatan:
- Warna merah muda yang dihasilkan: Urease positif.
- Warna merah muda tidak dihasilkan: Urease negatif.



