Osmosis (tekanan osmotik): Ini dapat didefinisikan sebagai tekanan yang harus diterapkan pada solusi untuk menghentikan aliran bersih pelarut melalui membran semipermeabel.
Apa itu Tekanan osmotik
Tekanan osmotik adalah salah satu dari empat sifat koligatif larutan (mereka bergantung pada jumlah partikel dalam larutan, terlepas dari sifatnya). Tekanan osmotik itu adalah salah satu karakteristik utama yang diperhitungkan dalam hubungan cairan yang membentuk lingkungan internal makhluk hidup, karena membran plasma mengatur masuk dan keluarnya zat terlarut ke dalam lingkungan ekstraseluler yang mengelilinginya, bertindak sebagai penghalang kontrol.
Ulasan sejarah
Penemuan fenomena osmotik dan studi pertama terkait dengan sejarah penciptaan ilmu abad ke-19: biologi, kimia, dan fisikokimia.
Biologi sebagai ilmu muncul secara praktis pada tahun 1800, ketika Marie-Francois-Xavier Bichat (1771-1802) mendefinisikan kehidupan sebagai “seperangkat fungsi yang melawan kematian”, dipahami sebagai perilaku materi yang lembam. Gagasan semacam itu menjadi ilmiah karena menunjukkan pemisahan tiga kingdom: tumbuhan, hewan, dan mineral; Selain itu, ia mengaitkan dengan tumbuhan dan hewan dengan prinsip internal pengembangan.
Bichat dan ahli biologi lainnya pada waktu itu memahami gagasan kehidupan ini sebagai prinsip vital, konsekuensi dari perkembangan materi inert yang tinggi. Dengan kata lain, dapat diterima bahwa fenomena biologis dapat dijelaskan melalui fisika dan kimia. Bichat, yang mendirikan histologi pada tahun 1844, secara eksplisit mengakui kimia sebagai model dengan mencatat bahwa jaringan terdiri dari unsur-unsur unsur.
Di antara pengetahuan dasar yang merupakan bagian dari awal ilmu biologi adalah gagasan evolusi kehidupan, yang memberi makna dinamis pada konsep Bichat. Dalam konsep evolusi ini, perubahan terjadi untuk menangkal dunia yang terus-menerus mengancam sedemikian rupa sehingga fungsi dan organ ditentukan oleh evolusi menuju keberlangsungan komunitas.
Abad ke-19 menonjol karena konflik ideologis yang sangat memengaruhi perkembangan ilmiah dan industri. Mengenai biologi sebagai ilmu, reaksi Theodor Schwann (1810-1882) terhadap foto-foto dalam lampiran fotografis, terhadap “vitalisme finalistik”, memaksakan gagasan tentang asal-usul makhluk hidup oleh kekuatan fisik semata. Hal ini mendorong para ahli fisiologi untuk mengamati sel secara intensif dan memberi jalan bagi embriologi dasar. Dengan kemajuan mengejutkan dalam histologi dan embriologi yang tercatat pada paruh pertama abad ke-19.
Pada akhir abad ke-19, perkembangan kimia di Rusia menerima dorongan yang menentukan dengan karya D. I. Mendeleiev (1834-1907), yang menerbitkan klasifikasi periodik unsur-unsur tersebut. Penemuan ini memaksa komunitas ilmiah Eropa untuk memahami dan menganalisis data dan, di atas segalanya, sebuah disiplin ilmiah di mana ia mendominasi rasa objektivitas alam dan mengesampingkan perasaan positivis waktu itu. Ini terjadi karena signifikansi modal yang disediakan oleh tabel Mendeleev tidak dipahami oleh ahli kimia kontemporer dan, sebaliknya, memerlukan modifikasi radikal dari prinsip-prinsip organisasi materi. Semangat inilah yang kemudian mendominasi fisika atom pada awal abad ke-20 dan yang memungkinkan evolusi menuju kimia kuantum.
Apa itu Osmosis
Secara osmosis diketahui fenomena difusi air melalui membran semipermeabel (juga dikenal sebagai permeabilitas diferensial atau permeabilitas selektif).
Contoh dari jenis membran ini adalah membran sel, serta produk-produk seperti tabung dialisis dan selulosa asetat selubung dari beberapa sosis.
Kehadiran zat terlarut mengurangi potensi air suatu zat, oleh karena itu ada lebih banyak air per unit volume dalam segelas air mengalir daripada dalam volume yang setara air laut.
Dalam sel, yang memiliki organel dan molekul besar, arah aliran air umumnya menuju bagian dalam sel.
Rumus Tekanan Osmotik
Perhatikanlah gambar berikut ini.
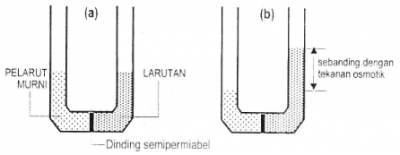
Gambar. Gejala Osmosis: (a) keadaan awal, dan (b) keadaan akhir.
Gambar di atas memperlihatkan gejala osmosis pada larutan. Osmosis merupakan suatu proses pergerakan molekul pelarut dari pelarut murni (atau larutan encer) ke larutan lebih pekat melalui dinding/selaput semipermiabel. Dinding/selaput semipermiabel adalah benda yang hanya dapat dilewati oleh molekul-molekul pelarut (air).
Molekul-molekul pelarut bergerak masuk dan larutan encer ke larutan yang lebih pekat. Molekul pelarut yang masuk ini membuat permukaan larutan pekat naik. Kenaikan permukaan ini disebabkan oleh adanya suatu tekanan yang melawan gaya hidrostatik larutan pekat.
Tekanan inilah yang disebut tekanan osmotik larutan. Gaya hidrostatik ditimbulkan oleh tinggi permukaan suatu cairan.
Selama tekanan osmotik yang ditimbulkan oleh larutan encer lebih besar dari tekanan hidrostatik dari larutan pekat maka permukaan larutan pekat terus merambat naik. Suatu saat permukaan larutan pekat berhenti merambat naik; berarti pada saat ini kedua gaya yang saling berlawanan itu sama besar dan berada dalam keadaan setimbang.
Dengan kata lain, tekanan osmotik larutan encer sama dengan tekanan hidrostatik larutan pekat.
Ketika Raoult (1897) menemukan hubungan tekanan uap antara larutan encer dan pelarut murninya, J.H. van`t Hoff menemukan bahwa tekanan osmotik (simbol: p) dari larutan encer memenuhi sebuah persamaan yang analog dengan persamaan gas ideal (PV = nRT), yaitu:
![]()
Dimana;
π = tekanan osmosis (dalam Tan)
n = jumlah mol zat terlarut (dalam mol)
V = volume larutan (dalam liter)
T = suhu larutan (dalam Kevin), dan
R = tetapan gas ideal (dalam L Tan.mol-1.K-1)

Di mana;
- π = tekanan osmosis (dalam atm)
- C = konsentrasi larutan (dalam molar),
- wA = massa zat terlarut A (dalam g), dan
- MA = Mr zat terlarut A (dalam g/mol).
Persamaan di atas memperlihatkan bahwa tekanan osmotik larutan merupakan sifat larutan yang termasuk sifat koligatif larutan. Mengapa? Karena gejala tekanan osmotik juga bergantung pada jumlah partikel zat terlarut dan bukan pada jenisnya.
Menurut persamaan a atau b, suatu larutan berkonsentrasi 1,0 M mempunyai tekanan osmotik larutan sebesar 22,4 atm pada 0°C.
- π = C.R.T
- = (1,0 mol.L-1)(0,082 atm.mol-1.K-1)(273 K) = (1,0)( 0.082)( 273) atm.
- = 22,4 atm.
Dua larutan yang terpisah oleh selaput semipermiabel tidak akan mengalami osmosis apabila konsentrasi (kepekatan) keduanya sama. Kedua larutan yang tidak mengalami osmosis ini di sebut sebagai larutan isotonik. Sementara untuk larutan encer disebut larutan hipotonik terhadap larutan yang lebih pekat sebaliknya larutan pekat disebut larutan hipertonik terhadap larutan yang lebih encer.
Osmosis memainkan peran penting dalam proses sistem hidup termasuk di dalam tubuh. Sebagai contoh, selaput yang membungkus sel darah merah bersifat semipermiabel. Keberadaan sel dalam lingkungan larutan yang satu terhadap lainnya bersifat relatif hipertonik akan dapat menyebabkan air keuar-masuk sel. Proses keluarnya air dari dalam sel dikenal sebagai krenasi, dan dapat mengakibatkan sel mengkerut. Bila sebaliknya yang terjadi, disebut hemolisis, dan berakibat sel akan mengembang. Krenasi terjadi jika cairan di luar sel lebih pekat; atau sebaliknya terjadi hemolisis bila cairan di luar sel lebih encer.
Orang yang memperoleh penggantian cairan darah atau makanan melalui infus harus bersifat isotonik terhadap cairan dalam sel darah merah orang tersebut. Hal ini untuk menghindarkan terjadinya kreasi atau hemolisis pada sel darah merah.
Osmosis juga dapat berlangsung ke arah larutan yang lebih encer yang dikenal sebagai osmosis-balik. Hal ini dapat terjadi bila dari atas permukaan cairan pekat ini diberikan tekanan tambahan untuk mendorong permukaan cairan pekat ke arah bawah searah gaya hidrostatik, Akibatnya, molekul pelarut akan mengalir balik ke arah cairan yang lebih encer. Osmosis-balik diterapkan untuk memperoleh air bersih dari air laut. Cara ini dijumpai di beberapa negara Timur Tengah.
Dinding sel
Tidak seperti sel hewan, bakteri dan sel tumbuhan dikelilingi oleh dinding sel yang kaku, dalam hal ini
- Ketika mereka berada di media hipotonik, air yang menembus oleh aliran osmotik menghasilkan tekanan turgor yang mendorong sitosol dan membran plasma ke dinding sel.
- Sebaliknya, dalam larutan hipertonik, sel-sel menarik kembali, memisahkan membran dari dinding sel sebagai konsekuensi dari hilangnya air oleh aliran osmotik (sebuah fenomena yang dikenal sebagai plasmolisis).
Organisme uniseluler seperti Paramecium, dan organisme hidup bebas lainnya di air tawar, memiliki masalah bahwa mereka biasanya hipertonik dalam kaitannya dengan lingkungan mereka. Karena itu air cenderung mengalir melalui membran, membengkak sel dan akhirnya memecahnya, sehingga menyusahkan sel apa pun. Vakuola kontraktil adalah respons Paramecium terhadap masalah ini, walaupun memompa air keluar dari sel membutuhkan energi karena berfungsi melawan gradien konsentrasi.
Protein membran
Karena interior hidrofobiknya, lapisan ganda lipid dari suatu sel merupakan penghalang yang sangat kedap terhadap sebagian besar molekul polar. Fungsi penghalang ini sangat penting karena memungkinkan sel untuk menyimpan zat terlarut tertentu dalam sitosolnya pada konsentrasi yang berbeda dari yang ada dalam cairan ekstraseluler; hal yang sama terjadi pada setiap kompartemen intraseluler yang diselimuti oleh membran. Perkembangan evolusi telah menciptakan sistem seluler yang secara khusus dimaksudkan untuk mengangkut molekul-molekul yang larut dalam air, memecahkan masalah isolasi sel.
Transportasi molekul dilakukan oleh protein yang diintegrasikan ke dalam membran sel. Ini umumnya sangat selektif ketika datang ke bahan kimia yang memungkinkan untuk dilewati.
Kelas utama
Tiga kelas utama protein membran (semuanya transmembran) yang campur tangan dalam perjalanan molekul melalui itu adalah:
Protein Saluran yang membentuk “terowongan” yang memungkinkan aliran air dan elektrolit yang mendukung gradien konsentrasi atau potensi listrik (mereka membentuk saluran yang melintasi bilayer dengan segala ketebalannya). Partikel yang lewat dipilih sesuai dengan ukuran dan muatannya. Mereka biasanya tertutup dan terbuka ketika dihadapkan dengan rangsangan tertentu. Bagian ini dibuat sesuai dengan gradien konsentrasi molekul.
Sel yang memiliki permeabilitas air tinggi memiliki saluran yang memfasilitasi masuknya air. Protein yang bertanggung jawab: aquoporin, diidentifikasi oleh Peter Agre di eritrosit pada pertengahan 1980-an.
Bagaimana cara kerja aquaporin?
Pada tahun 2000, bersama dengan tim peneliti lainnya, Agre melaporkan gambar pertama dari struktur tiga dimensi aquaporin. Dengan data ini, dimungkinkan untuk melacak secara rinci bagaimana saluran air bekerja. Mengapa itu hanya mendukung molekul air dan bukan molekul atau ion lain? misalnya, itu tidak memungkinkan proton untuk lewat. Ini sangat penting karena perbedaan konsentrasi proton antara bagian dalam dan bagian luar sel adalah dasar dari sistem penyimpanan energi sel.
Selektivitas adalah sifat utama dari aquaporin. Karena muatan positif di tengah saluran, ion bermuatan positif ditolak. Ini mencegah berlalunya proton melalui itu. Molekul-molekul yang masuk melalui saluran sempit mengatur ulang diri mereka sendiri, mengarahkan diri mereka sendiri di medan listrik lokal yang dibentuk oleh atom-atom dinding. Proton (atau lebih tepatnya ion oksonium, H3O +) berhenti di jalan dan ditolak karena muatan positifnya.
- pompa: mereka menggunakan energi (disediakan oleh ATP) untuk mengangkut molekul melawan gradien konsentrasi.
- Pengangkut: protein jenis ini, setelah memperbaiki molekul yang akan diangkut (A),
