Kompleks Histokompatibilitas Utama dan Sel Penyajian Antigen!
Sel Penyaji Antigen (APC):
Sel yang memproses dan menyajikan antigen asing dalam bentuk yang dapat dikenali oleh sel T disebut sel penyaji antigen.
Hampir semua sel dapat bertindak sebagai APC. Oleh karena itu semua sel harus disebut APC. Namun, secara konvensional, sel (makrofag, monosit, sel B, dan sel dendritik) yang menghadirkan antigen asing yang berasosiasi dengan molekul MHC kelas II ke sel T helper (CD4 + ) disebut sel penyaji antigen karena mereka menangkap berbagai zat. dan mempresentasikannya ke sel T pembantu.
Sedangkan sel yang menghadirkan antigen asing bersama dengan molekul MHC kelas I ke sel T sitotoksik (CD8 + ) disebut sel target. Sel yang terinfeksi virus adalah sel target yang penting. Sel diri yang diubah seperti sel kanker dan sel cangkok yang ditransplantasikan juga disebut sel target.
Sel-sel penyaji antigen yang penting adalah:
saya. Monosit dan makrofag
- Sel Dendritik
aku aku aku. Sel B
Makrofag tersebar luas di dalam tubuh dan memiliki kapasitas fagositik. Jadi mereka memainkan peran utama dalam presentasi antigen dari banyak mikroba yang masuk ke dalam tubuh. Selain itu, makrofag memiliki reseptor Fc, di mana mereka dapat menelan antigen yang dilapisi antibodi dan kemudian menyajikan antigen ini ke sel T.
Tergantung pada lokasi dalam tubuh, sel dendritik memiliki nama yang berbeda. Di epidermis kulit disebut sel Langerhans dan di organ limfoid disebut sel interdigitasi. Mereka berasal dari sumsum tulang dan berbentuk laba-laba karena perpanjangan proses sitoplasma, yang disebut dendrit.
Tetapi mereka mengekspresikan molekul MHC Kelas II yang melimpah di permukaannya dan menghadirkan antigen ke sel T pembantu. Mereka dapat bermigrasi melalui darah atau getah bening. (Misalnya, dalam beberapa menit setelah aplikasi bahan kimia pada kulit, sel Langerhans membawa antigen kimiawi ke kelenjar getah bening regional, menyajikan antigen ke sel T pembantu, dan memulai respons imun.)
Sel B tidak memiliki aktivitas fagositik yang signifikan. Namun mereka menangkap antigen melalui imunoglobulin permukaannya dan menginternalisasi antigen ke dalam sel. Antigen yang diinternalisasi kemudian dipresentasikan ke sel T helper.
Protein Kompleks Histokompatibilitas Utama:
Pada tahun 1930-an ditemukan bahwa penerimaan atau penolakan cangkok jaringan dari satu hewan (donor) ke hewan lain (penerima) bergantung pada kelompok antigen tertentu pada kedua hewan. Jika kelompok antigen serupa antara hewan donor dan penerima, cangkok diterima; jika tidak, korupsi ditolak.
Nama antigen histokompatibilitas diciptakan untuk antigen yang terlibat dalam penerimaan atau penolakan cangkok. (Histokompatibilitas = kemampuan untuk menerima transplantasi jaringan dari satu individu oleh individu lain.) Belakangan, wilayah kromosom tertentu ditemukan memainkan peran utama dalam penerimaan cangkok atau penolakan cangkok. Wilayah kromosom ini disebut histokompatibilitas utama (kompleks MHO.
Sistem kekebalan berada di bawah kendali gen. Banyak gen yang mengatur fungsi kekebalan ditemukan di wilayah kromosom yang dikenal sebagai kompleks histokompatibilitas utama (MHC). Dari semua gen yang terlibat dalam histokompatibilitas, gen MHC memainkan peran penting dan karenanya diberi nama kompleks histokompatibilitas utama.
MHC awalnya ditemukan karena perannya dalam perkebunan trans. Sekarang diketahui bahwa MHC juga memainkan banyak peran penting lainnya dalam reaksi imun seperti presentasi antigen ke limfosit dan interaksi antara sel limfoid.
Ada dua kelas gen MHC yang disebut gen MHC kelas 1 dan gen MHC kelas II dan molekul protein yang dikodekan oleh gen ini masing-masing disebut protein MHC kelas I dan protein MHC kelas II. Setiap protein MHC mengikat satu peptida antigen.
Semua sel berinti (kecuali sel sperma) dan trombosit pada manusia mengekspresikan molekul MHC kelas I pada permukaannya. Tetapi molekul MHC kelas II diekspresikan terutama pada permukaan monosit, makrofag, sel B, dan sel dendritik (Tabel 11.1). Molekul MHC kelas II juga disebut sebagai antigen la (antigen respons imun).
Struktur protein MHC kelas I dan kelas II diberikan pada Gambar 11.1. Molekul kelas I dan kelas II diekspresikan sebagai protein permukaan yang terikat membran di mana fitur polimorfiknya berorientasi ke luar sel. Setiap protein MHC terdiri dari dua rantai polipeptida yang terhubung secara non-kovalen.
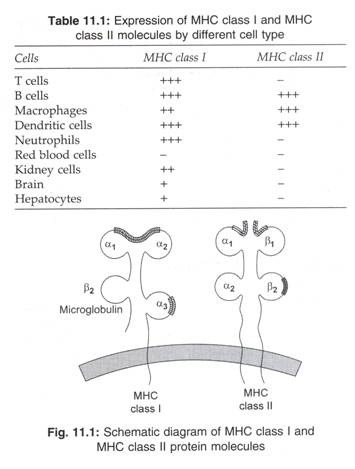
Struktur Protein MHC Kelas I:
Molekul MHC Kelas I terdiri dari:
saya. Rantai 44.000 dalton α (glikoprotein) yang dikodekan oleh gen kelas I pada kromosom 6, dan
- Mikroglobulin 12.000 dalton β 2 yang dikodekan oleh gen dalam kromosom 15.
Terminal karboksil dari rantai a berlabuh ke membran sitoplasma sel. Bagian ekstraseluler dari rantai dilipat menjadi tiga domain berbeda yang disebut α 1 , α 2 , dan α 3 .
Bagian ekstraseluler dari domain al dikaitkan dengan polipeptida yang lebih kecil yang disebut α 1 mikroglobulin. Asosiasi mikroglobulin β 2 dengan domain al sangat penting untuk menstabilkan molekul kelas I dan memfasilitasi transpornya ke permukaan sel.
Alur pengikatan peptida antigen molekul kelas I (yaitu situs, di mana peptida antigen berikatan dengan molekul kelas I) dibentuk oleh celah antara domain α 1 dan α 2 . Domain a3 berikatan dengan molekul CDS pada sel CD8 + T selama presentasi antigen.
β 2 Mikroglobulin:
β 2 mikroglobulin adalah peptida non-glikosilasi. Itu terikat pada domain al rantai kelas I di luar membran plasma. Mikroglobulin β 2 tidak melekat pada membran sel. Meskipun mikroglobulin β 2 dikaitkan dengan kompleks antigen MHC kelas I, ia tidak membentuk bagian dari tempat pengikatan antigen molekul kelas I. Namun β 2 diperlukan untuk pemrosesan dan ekspresi molekul kelas I. Jika sebuah sel secara kongenital kekurangan mikroglobulin P2, molekul kelas I tidak diekspresikan oleh sel tersebut.
Struktur Protein MHC Kelas II:
Molekul MHC Kelas II adalah dimer yang dibentuk oleh satu rantai (31.000-dalton) dan satu rantai β (27.000-dalton). Terminal karboksil dari kedua rantai berlabuh ke membran sel. Rantai α memiliki dua domain (α 1 dan α 2 ) dan rantai β memiliki dua domain (β 1 dan β 2 ). Alur pengikatan peptida antigen dibentuk oleh domain α 1 dan β 1 . Molekul CD4 pada sel CD4 + T menghubungi domain β 2 .
Mikroorganisme Ekstraseluler dan Intraseluler:
Setelah masuk ke dalam inang jika mikroorganisme hidup di luar sel inang disebut mikroorganisme ekstraseluler. Mikroorganisme yang hidup di dalam sel inang disebut mikroorganisme intraseluler. Mekanisme pengenalan mikroba ekstraseluler dan mikroba intraseluler oleh sistem imun berbeda.
Akibatnya, mekanisme efektor yang membunuh mikroba ekstraseluler dan mikroba intraseluler juga berbeda. Umumnya, mikroba intraseluler dikenali melalui jalur kelas I dan dibunuh melalui mekanisme cell-mediated immune (CMI). Sedangkan mikroba ekstraseluler dikenali melalui jalur kelas II dan dibunuh melalui mekanisme humoral.
Pengenalan Antigen Asing oleh Limfosit T:
Untuk respons imun yang efektif melawan antigen asing, sel T harus diaktifkan melawan antigen asing. Aktivasi sel T merupakan pusat mekanisme efektor yang terlibat dalam eliminasi antigen asing.
Sebelum meluncurkan respons efektor imun, sel T harus mengetahui bahwa antigen asing telah masuk ke dalam inang. Sel T sendiri tidak mengenali antigen secara langsung. (Sedangkan, sel B secara langsung mengenali dan mengikat antigen dalam cairan tubuh melalui imunoglobulin permukaan pada membran sel B.) Sel T memerlukan sel lain yang disebut sel penyaji antigen (APC) untuk menyajikan antigen kepada mereka. (misalnya, Polisi menangkap seorang pencuri dan membawanya ke inspektur polisi untuk tindakan lebih lanjut terhadap pencuri tersebut.) Ada dua cara dimana APC menghadirkan antigen ke sel T, yang disebut jalur kelas I dan jalur kelas II. Setelah mengenali antigen melalui APC, sel T menjadi aktif dan meningkatkan respons imun terhadap antigen.
Pemrosesan Antigen dan Presentasi Antigen oleh APC ke Limfosit T:
Sistem kekebalan yang didapat terutama mengenali antigen protein pada zat asing. APC membelah antigen protein asing menjadi peptida kecil dan kemudian menyajikan antigen peptida pendek ini ke sel T. Proses pembelahan protein asing menjadi peptida oleh APC disebut pemrosesan antigen dan proses membuat peptida antigen ini dapat diakses untuk dikenali oleh sel T disebut presentasi antigen.
Ada dua cara pemrosesan dan penyajian antigen oleh APC yang disebut jalur kelas I dan jalur kelas II.
Jalur Kelas I (Sitosolik):
Virus hidup di dalam sel inang (dan karenanya disebut mikroba intraseluler) dan menggunakan mesin sel inang untuk menghasilkan protein virus. Protein virus yang disintesis di dalam sel inang disajikan pada permukaan sel inang yang terinfeksi melalui jalur yang disebut jalur kelas I (Gambar 11.2 dan 11.3).
Proteasom dan LMP:
Tingkat protein dalam sel eukariotik diatur oleh sintesis protein dan degradasi protein. Protein di dalam sel didegradasi menjadi peptida pendek oleh kompleks protease sitosol yang disebut proteasom (Gambar 11.3). Proteasome adalah partikel silinder besar yang terdiri dari empat cincin subunit protein dengan saluran pusat 10-50A. protein kecil yang disebut ubiquitin melekat pada protein yang akan didegradasi oleh proteasome. Degradasi protein terkonjugasi ubiquitin diperkirakan terjadi di dalam pesona pusat proteasome.
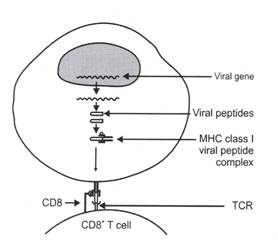
Gambar 11.2:
Diagram skema jalur kelas I pemrosesan antigen dan presentasi antigen. Genom virus dalam inti sel inang yang terinfeksi virus ditranskripsi dan diterjemahkan menjadi peptida virus. Peptida virus dikomplekskan dengan molekul MHC kelas I sel inang untuk membentuk kompleks peptida virus kelas I MHC. Kompleks ini diekspresikan pada permukaan membran sel yang terinfeksi virus dan dipresentasikan ke sel T CD8+. Reseptor sel T sel CD8 + T berikatan dengan kompleks peptida virus MHC kelas II dan pengikatan tersebut mengarah pada aktivasi sel T CD8 + terhadap peptida virus
LMP2, LMP7 (keduanya dikodekan oleh gen di kompleks MHC), dan LMP 10 (dikodekan oleh gen bukan di kompleks MHC) adalah protein kecil. Protein LMP2, LMP7, dan LMPIO ditambahkan ke proteasome. Penambahan LMP2, LMP7, dan LMPIO ke proteasome memodifikasi aktivitas proteolitik dari proteasome, sehingga peptida yang mungkin berikatan dengan molekul MHC kelas I dihasilkan oleh proteasome.
Peningkatan kadar IFNγ menginduksi produksi LMP2, LMP7, dan LMPIO.
Transporter Terkait dengan Pemrosesan Antigen (TAP):
Transporter yang terkait dengan pemrosesan antigen adalah protein RER yang merentang membran. TAP terdiri dari dua rantai protein yang disebut TAP1 dan TAP2, yang menjangkau membran RER (Gbr. 11.3). TAP milik keluarga protein kaset pengikat ATP, yang memediasi transpor asam amino, peptida, gula, dan ion yang bergantung pada ATP. TAP memiliki afinitas lebih besar terhadap peptida dari 8 hingga 13 asam amino, yang merupakan panjang peptida optimal yang cocok untuk mengikat molekul MHC kelas I.
TAP tampaknya mengangkut peptida dengan asam amino terminal karboksil hidrofobik atau basa, yang merupakan residu jangkar yang disukai untuk molekul MHC kelas I. Oleh karena itu, tampak bahwa peptida transpor TAP yang cocok untuk berikatan dengan molekul MHC kelas I.
Gen TAP1 dan TAP2 terletak di dalam wilayah kelas II kompleks MHC yang berdekatan dengan gen LMP2 dan LMP7.
Virus menginfeksi hampir semua jenis sel berinti manusia. Semua sel berinti pada manusia mengekspresikan molekul MHC kelas I pada membran selnya. Oleh karena itu, setiap sel berinti pada manusia mampu menghadirkan antigen virus (jika sel tersebut terinfeksi oleh virus) pada membran selnya yang mengarah ke pengenalan sel yang terinfeksi virus oleh sel T CD8 + . Akibatnya, virus tidak dapat bersembunyi dari serangan kekebalan dan manusia mengatasi infeksi virus.
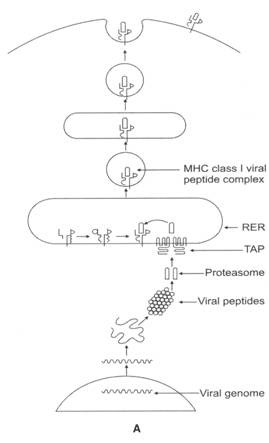
Gambar 11.3A dan B: (A) Diagram skematis perakitan rantai polipeptida IVIHC kelas I dan peptida virus serta ekspresi kompleks peptida virus kelas I MHC pada membran permukaan sel penyaji antigen.
Genom virus dalam sel inang yang terinfeksi virus ditranskripsi dan diterjemahkan menjadi polipeptida virus. Proteasome mendegradasi polipeptida virus menjadi peptida virus pendek. TAP mengangkut peptida virus pendek ke retikulum endoplasma kasar (RER). Di dalam RER, peptida virus berikatan dengan molekul MHC kelas I untuk membentuk kompleks peptida virus MHC kelas I. Kompleks meninggalkan RER dan mencapai Golgi. Dari Golgi, kompleks keluar sebagai vesikel eksositik.
Membran vesikel eksositik menyatu dengan membran sel dari sel inang yang terinfeksi virus, menghasilkan ekspresi kompleks ke aspek eksternal sel, di mana ia dapat dikenali oleh sel T CD8 + , dan (8) Diagram skematis dari perakitan kompleks peptida virus MHC kelas I dalam RER.
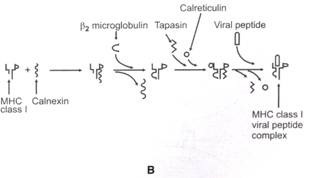
Di dalam RER, calnexin berasosiasi dengan MHC class la chain. Mikroglobulin Pg berasosiasi dengan rantai kelas la dan calnexin dilepaskan dari rantai α. Calreticulin dan tapasin berasosiasi dengan rantai kelas la dan Pg. Peptida virus yang masuk ke RER berikatan dengan molekul MHC kelas I. Selanjutnya, calreticulin dan tapasin berdisosiasi dari molekul kelas I
Setiap sel memiliki potensi besar untuk menghadirkan sejumlah peptida antigenik yang berasal dari virus apa pun, yang telah menginfeksi sel. Hal ini meningkatkan kemungkinan sel yang terinfeksi dikenali dan dibunuh oleh sel T sitotoksik yang berbeda dengan spesifisitas antigen yang berbeda.
Jalur Kelas II (Endokitis):
Tidak seperti virus, sebagian besar bakteri bersifat ekstraseluler (yaitu bakteri hidup dan berkembang biak di luar sel inang). Makrofag adalah sel fagosit yang paling penting. Makrofag menelan bakteri di lingkungan luar melalui proses yang disebut endositosis (phago cytosis dan pinocytosis). Endosom yang mengandung bakteri bergabung dengan lisosom. Lisosom mengandung lebih dari 40 hidrolase yang bergantung pada asam termasuk protease, nuklease, glikosidase, lipase, fosfatase, dan fosfatidase. Enzim lisosom membelah protein bakteri menjadi sejumlah fragmen peptida pendek. Fragmen peptida antigen bakteri pendek dikomplekskan menjadi molekul MHC kelas II dan dipresentasikan ke reseptor sel T dari sel T CD4+ (Gbr. 11.4).
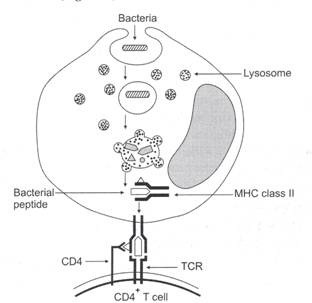
Gambar 11.4: Diagram skematik jalur pemrosesan antigen dan presentasi antigen kelas II.
Bakteri di lingkungan ekstraseluler ditelan oleh makrofag. Membran fagosom menyatu dengan membran lisosom dan enzim dalam lisosom membelah bakteri menjadi fragmen peptida pendek. Molekul MHC kelas II berikatan dengan peptida bakteri untuk membentuk kompleks peptida bakteri MHC kelas II.
Kompleks ini diekspresikan pada permukaan makrofag dan dipresentasikan ke sel T CD4 + . TCR sel T CD4 + berikatan dengan kompleks peptida bakteri MHC kelas II pada permukaan makrofag. Akibatnya, sel CD4 + T diaktifkan melawan peptida bakteri di kompleks peptida bakteri MHC kelas II
Langkah-langkah Berurutan Pengikatan Molekul Kelas II dengan Peptida Antigen Bakteri:
Molekul MHC kelas II terdiri dari dua rantai polipeptida yang disebut rantai dan rantai P (Gambar 11.1). Seperti molekul MHC kelas I, molekul MHC kelas II juga disintesis pada polisom di sepanjang retikulum endoplasma kasar (RER). Molekul kelas n ditakdirkan untuk mengikat peptida yang berasal dari lingkungan ekstra seluler sel.
Oleh karena itu molekul kelas II tidak boleh berikatan dengan peptida endogen (seperti peptida virus), yang juga masuk ke dalam RER. Pengikatan peptida endogen ke molekul kelas II dicegah oleh rantai polipeptida yang disebut “rantai invarian”. Rantai invarian berasosiasi dengan alur pengikat antigen dari molekul MHC kelas II dan mencegah pengikatan peptida endogen ke molekul kelas II. Rantai invarian juga tampaknya memainkan peran penting dalam pelipatan rantai polipeptida a dan P molekul kelas II dan keluarnya dari RER ke kompleks Golgi (Gambar 11.5).
sebuah†”
Kompleks rantai invarian kelas Il diangkut dari RER ke kompleks Golgi dan dari kompleks Golgi ke endosome awal. Kompleks bergerak dari endosom awal ke endosom akhir. Enzim proteolitik dalam endosom menurunkan rantai invarian. Tetapi fragmen peptida pendek yang disebut CLIP (peptida rantai invarian terkait kelas Il) tetap berada di alur pengikat peptida molekul kelas II.
sebuah†”
Dari endosom akhir kompleks mencapai lisosom, yang berisi peptida antigen bakteri. Di dalam lisosom, fragmen CLIP dihilangkan dan peptida antigen bakteri berikatan dengan alur peptida dari molekul kelas II. Penghapusan CLIP dan pemuatan antigen peptida ke dalam molekul kelas II dikatalisis oleh protein lain yang disebut protein HLA-DM (dikodekan oleh gen HLA-DM).
sebuah†”
Kemudian lisosom yang mengandung kompleks peptida Il-antigen kelas bergerak ke membran sel. Membran lisosom menyatu dengan membran sel, menghasilkan tampilan kompleks peptida antigen-kelas Il ke arah aspek luar sel.
sebuah†”
Kompleks peptida Il-antigen kelas MHC pada permukaan sel dipresentasikan ke sel T helper (CD4 + ).
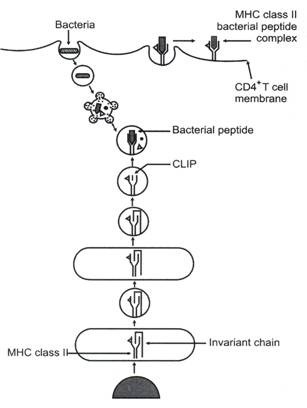
Gambar 11.5:
Diagram skematis langkah-langkah berurutan pengikatan molekul MHC kelas II dengan peptida antigen bakteri. Molekul MHC kelas II rantai α dan β disintesis dalam RER. Alur pengikat antigen molekul kelas II ditempati oleh rantai polipeptida yang disebut “rantai invarian”.
Molekul kelas II bersama dengan rantai invarian diangkut ke kompleks Golgi dan kemudian ke endosome awal. Pada endosom akhir, rantai Invarian terdegradasi, tetapi peptida kecil yang disebut CLIP tetap berada di alur pengikatan peptida. Di dalam lisosom, fragmen CLIP dihilangkan dan peptida antigen bakteri dimuat ke alur pengikat antigen untuk membentuk kompleks peptida bakteri MHC kelas II. Membran lisosom menyatu dengan membran makrofag dan mengekspresikan kompleks peptida bakteri MHC kelas II ke aspek eksternal makrofag, di mana ia dapat dikenali oleh sel T CD4 +
Jalur kelas II juga disebut “jalur eksogen” pemrosesan antigen karena bekerja terutama pada protein yang ditangkap dari luar APC.
Di dalam sel, molekul kelas I dan kelas II bergerak dalam rute yang berbeda dan kompleks ke peptida antigenik di kompartemen yang berbeda. Kompartementalisasi semacam ini membantu molekul kelas I dan kelas II untuk memperoleh peptida antigen yang berasal dari dua sumber yang berbeda (yaitu sumber intraseluler dan ekstra seluler). Molekul kelas I berikatan dengan peptida (seperti peptida virus) yang disintesis di dalam sel inang dan pengikatan terjadi di RER (Tabel 11.2). Di sisi lain, molekul kelas II tidak berikatan dengan peptida yang disintesis di dalam sel inang. Molekul kelas II berikatan dengan peptida yang berasal dari lingkungan ekstraseluler dan pengikatan terjadi di dalam lisosom yang mengandung peptida ekstraseluler.
Perlu dicatat bahwa pada jalur kelas II, peptida antigen asing tidak disintesis di dalam sel inang. (Sebaliknya, peptida antigen asing disintesis di dalam sel inang di jalur kelas I).
Pada saat dibutuhkan, pemrosesan antigen dan presentasi antigen oleh sel ditingkatkan. Misalnya, IFNγ menginduksi ekspresi molekul kelas I dan kelas II pada sel inang, menghasilkan peningkatan presentasi antigen ke sel T.
Sebaliknya, beberapa mikroba dapat meregulasi (yaitu menurunkan) ekspresi molekul MHC . Karena penurunan regulasi ekspresi molekul MHC, jumlah ekspresi antigen peptida juga menurun. Akibatnya, kemungkinan ekspresi antigen mikroba juga berkurang dan mikroba lolos dari pembunuhan. (Misalnya. Virus herpes simpleks menghasilkan beberapa protein yang memblokir jalur kelas I dalam sel yang terinfeksi virus herpes simpleks).
Perbedaan dalam Respons Kekebalan yang Diinduksi Oleh Vaksin Bunuh/Peptida dan Vaksin Virus Hidup:
Vaksin mati/peptida ditelan oleh makrofag dan diproses melalui jalur kelas II (karena vaksin mati/peptida ditelan dari luar makrofag dan tidak berkembang biak di dalam makrofag). Hal ini menyebabkan presentasi antigen vaksin yang terbunuh/peptida oleh makrofag melalui jalur kelas II ke limfosit T CD4 + . Vaksin mati / peptida juga mengikat imunoglobulin permukaan pada sel B dan mengaktifkan sel B.
Sel B yang teraktivasi mendapat bantuan dari sel T CD4 + yang teraktivasi dan mengeluarkan antibodi terhadap antigen vaksin yang terbunuh/peptida. Oleh karena itu, antibodi memainkan peran penting dalam perlindungan terhadap mikroba, yang diberikan vaksin mati/peptida. Vaksin mati/peptida tidak menginfeksi sel mana pun dan berkembang biak di dalam sel inang. Oleh karena itu antigen vaksin yang dibunuh/peptida tidak disajikan bersama dengan molekul MHC kelas I dan tanggapan sel T CD8 + tidak diinduksi terhadapnya.
Padahal, vaksin virus hidup menginfeksi sel inang dan berkembang biak di dalam sel inang. Akibatnya, antigen virus yang berasosiasi dengan molekul MHC kelas I dipresentasikan ke limfosit T sitotoksik. Hal ini menghasilkan perkembangan respon imun sitotoksik terhadap antigen virus. Namun, antibodi juga diinduksi terhadap vaksin virus hidup. (Beberapa virus hidup dalam vaksin mati atau dibunuh oleh mekanisme kekebalan. Virus yang terbunuh ditelan oleh makrofag dan dipresentasikan bersama dengan molekul MHC kelas II ke sel T pembantu.
Akibatnya, respons sel T penolong terhadap virus diinduksi. Beberapa virus hidup atau mati dari vaksin dapat secara langsung berikatan dengan imunoglobulin permukaan sel B dan menginduksi respons antibodi. Jadi antibodi juga terbentuk setelah vaksinasi virus hidup.) Tetapi antibodi tidak masuk ke dalam sel hidup dan menyerang virus intraseluler. Oleh karena itu, respons sel T sitotoksik adalah respons protektif utama yang diinduksi oleh vaksin virus hidup. Namun, antibodi dapat menyerang virus:
sebuah. dalam interval antara waktu masuknya virus ke dalam inang dan masuknya ke dalam sel inang, dan
- dalam interval waktu antara pelepasan virus dari sel yang terinfeksi dan selanjutnya masuk ke sel lain.
Aktivasi Limfosit T:
Limfosit T pembantu atau sitotoksik diaktifkan setelah pengikatan reseptor sel T (TCR) mereka ke kompleks peptida antigen-molekul MHC pada permukaan APC.
Peptida antigenik yang dikomplekskan ke molekul MHC memiliki dua tempat interaksi yang berbeda:
saya. Situs antigen yang berinteraksi dengan TCR disebut epitop.
- Situs interaksi lain yang berinteraksi dengan molekul MHC disebut agretope. TCR pada sel T adalah kompleks dari 8 protein transmembran. Diantaranya, rantai α dan β berikatan dengan peptida antigen di kompleks peptida antigen-MHC. 6 rantai protein TCR lainnya disebut kompleks CDS.
Aktivasi sel T membutuhkan dua pengikatan antara TCR sel T dan kompleks molekul-antigen peptida MHC pada APC.
Aktivasi Sel T Pembantu:
Aktivasi sel T helper membutuhkan dua pengikatan berikut:
saya. Rantai α dan β TCR sel T helper berikatan dengan peptida antigen di kompleks peptida Il-antigen kelas MHC.
- Molekul CD4 pada sel T helper berikatan dengan domain p2 molekul MHC kelas II.
Setelah dua pengikatan ini, kompleks CD3 TCR mengubah pengenalan antigen menjadi sinyal transmembran. Sinyal mengaktifkan sel T pembantu.
Aktivasi Sel T sitotoksik:
Aktivasi sel T sitotoksik membutuhkan dua pengikatan berikut:
saya. Rantai α dan β dari TCR sel T sitotoksik berikatan dengan antigen peptida dalam kompleks peptida antigen kelas I MHC pada APC.
- Molekul CD8 sel T sitotoksik berikatan dengan domain α 3 molekul MHC kelas I.
Setelah dua pengikatan ini, kompleks CDS sel T sitotoksik mengirimkan sinyal ke sel T sitotoksik, yang mengarah ke aktivasi sel T sitotoksik.
Pembatasan MHC Sel T:
Kita harus memahami arti dari “pembatasan MHC sel T”. “Sel T terbatas MHC Kelas I” berarti bahwa sel T mengenali antigen hanya ketika antigen disajikan bersama dengan molekul MHC kelas I. Oleh karena itu sel T CD8 + adalah sel T terbatas kelas I.
“Sel T terbatas MHC Kelas II”, berarti bahwa sel T hanya mengenali antigen bersama dengan molekul MHC kelas II saja. Jadi sel T CD4 + adalah sel T terbatas kelas II.
Pembatasan kelas I atau kelas II merupakan faktor penting dalam menentukan jenis respon imun yang diinduksi oleh antigen tertentu. Antigen virus dikomplekskan ke molekul kelas I dan dipresentasikan ke sel T CD8 + yang membunuh sel inang yang terinfeksi virus. Padahal, banyak antigen bakteri dikomplekskan dengan molekul kelas II dan dikenali oleh sel CD4 + T helper yang mengarah ke respons antibodi.
Antigen Leukosit Manusia HLa/Kompleks:
Pada tahun 1950-an, ditemukan bahwa orang yang melakukan transfusi darah berkali-kali dan wanita yang pernah hamil beberapa kali, memiliki beberapa antibodi dalam serumnya, yang bereaksi dengan leukosit manusia lain. Glikoprotein membran leukosit, yang bereaksi dengan antibodi ini, disebut antigen leukosit manusia (HLA).
Sekarang istilah HLA digunakan sebagai sinonim untuk protein major histocompatable complex (MHC) manusia.
Gen dalam kode kompleks HLA protein MHC. Pada manusia, kompleks HLA terletak pada lengan pendek kromosom 6, kira-kira 15 sentimorgan (jarak peta rekombinan) dari sentromer. Kompleks HLA meluas hingga sekitar 4000 kb dan lebih dari 100 gen terletak di dalam wilayah HLA.
Pada tikus, gen MHC terdapat pada kromosom 17, dan disebut kompleks H-2.
Regio kompleks gen HLA manusia digambarkan memiliki dua regio, regio kelas I dan regio kelas II (Gambar 11.6).

Gen Kelas I:
Wilayah gen kelas I HLA berada di ujung telomer kompleks HLA. Ada banyak gen di wilayah kelas I.
saya. Ada tiga gen kelas I yang dikenal sebagai HLA-A, HLA-B, dan HLA-C dan protein yang dikodekan oleh mereka (protein HLA-A, HLA-B, dan HLA-C, masing-masing) disebut protein histokompatibilitas MHC kelas I. .
- Gen untuk sitokin, tumor necrosis factor a (TNFa) dan tumor necrosis factor P (TNPP) terletak dekat dengan lokus HLA-B.
aku aku aku. Gen lain yang disebut gen HLA-G juga berada dalam wilayah kelas I.
Gen Kelas II:
Wilayah gen HLA Kelas II juga memiliki banyak gen.
saya. Ada tiga gen kelas II, yang dikenal sebagai HLA-DP, HLA-DQ, dan HLA-DR dan protein yang dikodekan oleh mereka (protein HLA-DP, HLA-DQ, dan HLA-DR, masing-masing) disebut protein MHC kelas II. .
- Gen untuk ‘transporter antigenic peptide-l’ (TAP-1).
aku aku aku. Gen untuk ‘transporter antigenic peptide-2’ (TAP-2).
- Gen untuk ‘protein 2 berat molekul rendah’ (LMP2).
- Gen untuk ‘protein berat molekul rendah 7’ (LMP7).
- Lokus gen HLA-DM juga berada dalam wilayah kelas II.
- Selain gen tersebut ada gen lain yang fungsinya belum diketahui.
Pada individu, kompleks HLA dalam satu kromosom memiliki tiga lokus kelas I (HLA-A, HLA-B, dan HLA-C) dan tiga lokus kelas II (HLA-DP, HLA-DQ, dan HLA-DR). Satu individu memiliki sepasang kromosom, satu dari ayah dan satu dari ibu. Oleh karena itu setiap individu memiliki enam lokus kelas I (dua lokus HLA-A, dua HLA-B, dan dua HLA-C) dan enam lokus kelas II (dua lokus HLA-DP, dua lokus HLA-DR, dan dua HLA-DQ).
Polimorfisme adalah istilah yang diterapkan pada lokus gen yang membawa dua atau lebih alel oleh anggota populasi yang berbeda (Sebaliknya, lokus gen monomorfik membawa alel yang sama di semua anggota populasi.) Ada banyak versi alternatif dari setiap gen MHC yang menghasilkan protein dengan urutan yang sedikit berbeda (yaitu ada banyak alel yang berbeda dari setiap gen).
Jumlah alel yang dikenali dari setiap lokus (sesuai dengan Grup Informatika HLA dari Anthony Nolan Bone marrow Trust) adalah:
alel HLA-A-124
alel HLA-B-258
alel HLA-DR-265
alel HLA-DQ-58
alel HLA-DP-99
Keragaman jenis ini disebut polimorfisme alelik. Kebetulan, gen HLA adalah sistem genetik paling polimorfik yang dikenal. Hampir semua polimorfisme di antara alel HLA- melibatkan urutan asam amino yang terletak di dalam dan sekitar alur pengikatan peptida antigen dari protein MHC.
Pada individu, semua gen HLA diekspresikan secara kodominan. Oleh karena itu ada enam protein kelas I (dua protein HLA-A, dua HLA-B, dan dua protein HLA-C) dan enam protein kelas II (dua protein HLA-DP, dua HLA-DQ, dan dua protein HLA-DR) pada permukaan sel.
Ketika kedua kromosom dalam kode individu protein HLA yang sama, individu tersebut dikatakan homozigot sehubungan dengan gen HLA tertentu (misalnya kedua kromosom kode HLA-A6). Jika gen dalam dua kromosom pada individu mengkode protein HLA yang berbeda, individu tersebut dikatakan heterozigot sehubungan dengan gen HLA tertentu (misalnya satu kromosom mengkode HLA-6 dan kromosom lain mengkode HLA-8).
Kode gen TAP-1 dan TAP-2 untuk protein yang terlibat dalam jalur endogen pemrosesan antigen.
Gen MHC Non Klasik:
Protein yang dikodekan oleh gen non klasik secara struktural mirip dengan protein kelas I atau kelas II, tetapi memiliki peran yang berbeda dalam imunitas (misalnya protein HLA-G mengontrol respons imun pada antarmuka janin-ibu).
Dengan demikian, kompleks gen HLA memiliki banyak gen yang terkait erat, yang sebagian besar terlibat dalam pemrosesan dan penyajian antigen. Namun, beberapa gen lain (seperti gen untuk faktor nekrosis tumor α dan β melengkapi faktor C2, C4, B dan F) di wilayah ini memiliki fungsi lain. Signifikansi hubungan mereka dengan gen MHC tidak diketahui.
Jalur Ketiga Presentasi Antigen:
Biasanya protein/glikoprotein mampu menginduksi respon imun yang didapat. Antigen protein/glikoprotein disajikan melalui jalur MHC kelas I atau MHC kelas II ke sel T yang mengarah ke aktivasi sel T. Namun, data terbaru menunjukkan kemungkinan adanya jalur ketiga dari presentasi antigen.
Jalur ketiga disarankan untuk menyajikan lipid antigenik dan glikolipid mikobakteri. Molekul keluarga CD1 dalam APC diyakini menghadirkan asam mikolat dari Mycobacterium tuberculosis dan lipoarabinomannan dari Mycobacterium leprae. Tetapi mekanisme dan langkah pasti yang terlibat dalam jalur presentasi antigen ketiga tidak diketahui.
Relevansi Klinis
MHC dan Asosiasi Penyakit:
Sejumlah penelitian keluarga dan populasi telah menunjukkan hubungan antara molekul MHC tertentu dan beberapa penyakit. Tabel 11.3 mencantumkan beberapa hubungan paling signifikan antara MHC dan penyakit. Seperti yang terlihat pada tabel banyak penyakit autoimun lebih sering terjadi pada orang yang membawa molekul MHC tertentu. Misalnya, pada populasi Kaukasia AS, seseorang yang memiliki molekul HLA-B27 memiliki risiko 80 kali lipat lebih tinggi terkena penyakit yang disebut ankylosing spondylitis, jika dibandingkan dengan orang yang tidak memiliki molekul HLA-B27.
Signifikansi HLA dan asosiasi penyakit tidak diketahui. Apakah molekul HLA tertentu bertanggung jawab atas perkembangan penyakit atau molekul HLA tertentu hanyalah penanda gen lain (yang mungkin terutama bertanggung jawab atas penyakit) tidak diketahui.
Hubungan MHC dan penyakit diindikasikan sebagai ‘risiko relatif’. Ini adalah rasio ganjil yang mencerminkan frekuensi relatif dari setiap penyakit pada individu dengan penanda HLA tertentu dibandingkan dengan frekuensi penyakit pada individu yang tidak membawa penanda tersebut.
Insiden penyakit pada pasien dengan tipe HLA tertentu dibandingkan dengan insiden penyakit pada pasien tanpa tipe HLA ini dan dinyatakan sebagai risiko relatif. Risiko relatif dihitung dengan membagi frekuensi alel HLA pada populasi pasien dengan frekuensi alel HLA pada populasi umum tertentu.
Risiko relatif = (HLA Ag + / HLA Ag + ) pada populasi penyakit / (HLA Ag + / HLA Ag + ) pada populasi kontrol
Tabel 11.3: Hubungan HLA dan penyakit autoimun di Kaukasoid:
|
alel HLA |
Penyakit autoimun |
Risiko relatif |
|
DR2 |
Sklerosis ganda |
4 |
|
DR2 |
Lupus eritematosus sistemik |
3.5 |
|
DR3 |
sindrom Spgren |
10 |
|
DR3 |
Penyakit celiac |
12 |
|
DR3 |
Diabetes melitus yang tergantung insulin |
5 |
|
DR3 |
Hepatitis aktif kronis |
14 |
|
DR4 |
Artritis reumatoid |
6 |
|
DR4 |
Pemphigus vulgaris |
24 |
|
B27 |
Spondilitis ankilosa |
90 |
Risiko relatif 1 menyiratkan bahwa alel HLA diekspresikan dengan frekuensi yang sama pada populasi pasien serta populasi kontrol dan oleh karena itu alel HLA tidak memberikan peningkatan risiko penyakit. Tetapi nilai risiko relatif yang lebih tinggi menyiratkan bahwa kemungkinan hubungan penyakit dengan alel HLA ini lebih besar; dan akibatnya, seseorang dengan alel HLA ini memiliki lebih banyak kesempatan untuk mengembangkan penyakit ini. (Misalnya, risiko relatif untuk penyakit hepatitis aktif kronis dan HLA DR3 adalah 14. Itu berarti individu dengan HLA DR3 memiliki peluang 14 kali lebih besar untuk mengembangkan hepatitis aktif kronis dibandingkan mereka yang kekurangan HLA DR3 pada populasi yang sama.)
Aplikasi Klinis Pengetikan HLA:
- Pengetikan HLA donor dan penerima merupakan prosedur penting sebelum transplantasi organ. Pengetikan HLA membantu mengidentifikasi donor yang memiliki antigen HLA yang mirip dengan antigen HLA penerima.
- Nilai klinis tipe HLA untuk diagnosis terbatas pada HLA B27 dan ankylosing spondylitis. Bahkan di sini orang harus mengingat kemungkinan 10 persen tingkat positif palsu dan negatif palsu.
- Studi HLA mungkin bermanfaat dalam konseling genetik dan pengenalan dini beberapa penyakit dalam keluarga (misalnya hemokromatosis idiopatik atau hiperplasia adrenal kongenital akibat defisiensi steroid 21-hidroksilase).
- Karena tingginya tingkat polimorfisme gen HLA dan produknya, pengetikan HLA adalah alat yang ampuh untuk pengetikan paternal dan aplikasi medikolegal lainnya. (Antigen golongan darah, HLA, protein serum, enzim sel darah merah, dan polimorfisme DNA individu adalah unik dan dapat digunakan untuk menentukan keturunan. Biasanya mungkin untuk mengecualikan orang yang dituduh salah; tetapi tes ini tidak dapat membuktikan bahwa orang tertentu laki-laki adalah ayah dari anak yang bersangkutan).
- Studi antropologi: Karena antigen sel darah merah dan HLA tertentu terbatas pada wilayah geografis tertentu, analisis frekuensi antigen ini menarik untuk mempelajari asal dan migrasi orang dari ras yang berbeda. Antigen seperti HLA-B8 dan HLA-Al umum pada orang Kaukasia asal Eropa, tetapi tidak ada pada orang Timur.



