Baca artikel ini untuk mendapatkan informasi tentang struktur protein! Pelajari tentang Wool a-Keratin, Cytochrome c, Hemoglobin, Immunoglobin G, Ribulose biphosphate carboxylase, dll.

https://houseofpain.com/wp-content/uploads/2013/05/Proteins.jpg
(1) Wol a-Keratin:
(i) Ini adalah protein berserat yang terdiri dari α-helix; Lembaran P-lipit dan membentuk struktur triple helix kolagen.
(ii) Struktur sekunder wol α-keratin adalah heliks tangan kanan.
(iii) Tiga α-heliks tersebut membentuk kumparan tangan kiri yang disebut protofibril yang distabilkan dengan ikatan silang disulfida.
(iv) Kumparan protofibril menjadi kabel seperti mikrofibril dengan diameter 8 nm.
(v) Beberapa ratus fibril mikro tertanam dalam matriks protein amorf membentuk fibril makro
(vi) Banyak fibril makro bersama-sama membentuk serat wol.
(vii) Ketika α-keratin terkena panas lembab dan diregangkan, ia berubah menjadi β-keratin.
Ikatan hidrogen yang menstabilkan struktur α-heliks diputus dan dihasilkan lembaran berlipat β paralel yang diperpanjang.
(2) Sitokrom c:
(i) Sitokrom c adalah protein globular yang kecil, stabil dan berwarna.
(ii) Atom besi tunggal dalam molekul sitokrom c bergantian antara keadaan oksidasi Fe II dan Fe III.
(iii) Cyt c memiliki 104-111 residu asam amino, 35 di antaranya ditemukan invarian dari spesies ke spesies.
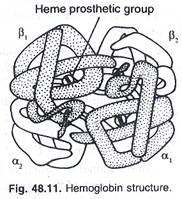
(3) Hemoglobin (Gbr. 48.11):
(i) Ini adalah protein transpor sel darah merah.
(ii) Besi heme terikat pada residu histidin di satu sisi bidang heme.
(iii) Pada oksigenasi, besi diligankan ke oksigen pada sisi berlawanan dari heme dalam kantong pada permukaan molekul hemoglobin.
(iv) Besi heme tetap dalam keadaan Fe II selama oksigenasi dan deoksigenasi.
(v) Tetramer α 2 β 2 berikatan dengan molekul 4-oksigen.
(vi) Asosiasi α,-β, berpasangan dengan α 2 -β 2 lebih lemah dari pada di dalam mereka.
(4) Imunoglobin G:
(i) Ini adalah protein globular terpenting yang terkait dengan molekul antibodi sistem kekebalan tubuh.
(ii) Ini adalah protein serum yang bergabung dengan antigen.
(iii) Struktur kuaterner I gG terdiri dari 4 rantai polipeptida, dua rantai ‘ringan’ dari sekitar 215 residu asam amino dan dua ‘rantai berat’ dari 500 residu asam amino.
(iv) 4 rantai dihubungkan oleh jembatan disulfida sebagai bentuk 12 domain. (Gbr. 48.12).
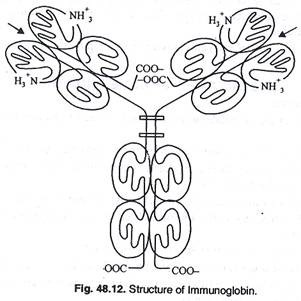
(v) Sambungan molekul berbentuk ‘Y’ memberikan kelenturan sehingga dua tempat penggabungan, yang terletak di setiap lengan ‘Y’, yang mengikat antigen, tidak harus berada pada jarak yang tetap.
(vi) Ada dua situs pengenalan antigen, jaringan rantai antigen antibodi akan terbentuk ketika antibodi bereaksi dengan antigen yang memiliki lebih dari satu situs yang dikenali oleh antibodi.
(5) Ribulosa bifosfat karboksilase (RUB1SCO):
(i) Ini adalah protein yang paling penting dalam tanaman yang mengkatalisis reaksi ribulosa 1, 5, bifosfat dengan CO 2 untuk menghasilkan dua molekul 3 fosfogliserat dalam reaksi pengikatan CO 2 . RUBISCO memiliki struktur kuaterner dengan 8 kecil, 100 protein residu asam amino dan 8 protomer residu 500 asam amino besar.
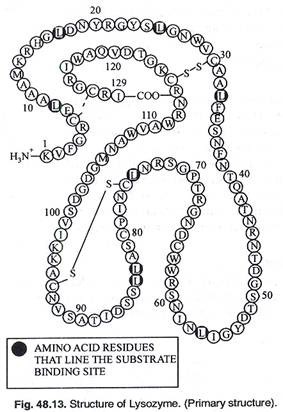
Polipeptida dalam tubuh kita terlipat menjadi struktur 3D yang kompleks. Struktur 3D dari Iysozyme diuraikan pada tahun 1965. Itu terdiri dari 129 asam amino dalam urutan linier dan bergabung dengan jembatan disulfida untuk membentuk konformasi 3D.
Struktur utama dibaca sebagai (NH 2 ) KVFGRCELAAAMKRHGLDNYR GYSLGNWVCAAKFESNFNTQATNRNTDGSTDYGILQINSRWW CDNGRTPGSRNLCNIPCSALLSSDITASVNCAKKIVSDGDGMN AWVAWRNRCKGTDVQAWIRGCRL (COOH).
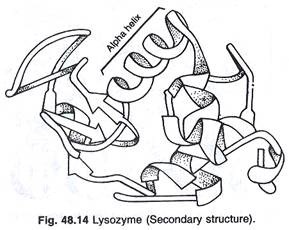
Model linear molekul (Gambar 48.13) agak tidak beraturan. Jika rantai samping dilepas dan jalur tulang punggung ikatan peptida ditarik, beberapa daerah protein tersusun dalam pola berulang. Ini menunjukkan pola a-helix dan p-sheet (Gbr. 48.14).
Di wilayah a-helix, rantai berputar dalam bentuk spiral sementara di (wilayah 3 lembar polipeptida berjalan berdampingan. Dalam konformasi tersier dapat terdapat alur, celah, dan tonjolan pada permukaan protein di mana rantai samping asam amino tertentu berada. diposisikan untuk membentuk situs yang mengikat ligan dan mengkatalisis reaksi.
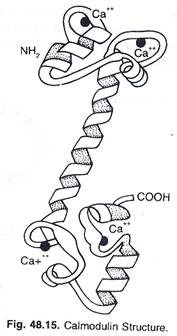
Dalam kalmodulin (protein pengikat kalsium), rantai tunggal disusun menjadi dua domain, dihubungkan hanya oleh satu rantai polipeptida. Kedua domain tersebut sangat mirip dan mungkin berasal dari duplikasi gen (Gambar 48.15).
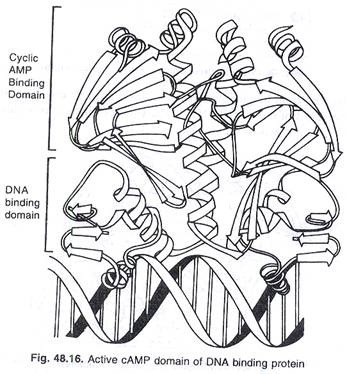
Protein pengaktif katabolit (CAP) dari E. coli berikatan dengan sekuens basa spesifik pada DNA yang membantu RNA polimerase untuk berikatan dengan promotornya dan memulai transkripsi lac Operon. Salah satu domain CAP memiliki tugas mengikat cAMP dan yang lain mengenali sekuens DNA menggunakan motif helix turn helix. Salah satu heliks ini cocok dengan alur utama DNA di mana ia dapat membuat interaksi spesifik dengan tepi-tepi dasar yang terbuka.
Memaksa membentuk bentuk protein:
Ikatan hidrogen:
Hidrogen memiliki valensi satu dan membentuk ikatan kovalen tunggal dengan atom lain. Namun, jika atom itu adalah oksigen, nitrogen, dan belerang, maka ia dapat menjadi donor dan berbagi hidrogennya dengan oksigen, nitrogen, dan belerang kedua (akseptor): Donor atau akseptor harus berada dalam jarak tetap satu sama lain (0,3 nm jarak), dengan hidrogen pada garis lurus di antara mereka. Dalam sebuah heliks-a, atom nitrogen dalam ikatan peptida berbagi hidrogennya dengan oksigen dari ikatan peptida empat di depannya dalam rantai polipeptida.
Interaksi Elektrostatik:
Jika residu asam amino positif atau negatif terkubur jauh di dalam protein, di mana tidak ada yang dapat berinteraksi dengan air, maka mereka akan menarik satu sama lain, dan akan sangat sulit untuk memisahkannya. Ikatan elektrostatik semacam itu di dalam protein disebut jembatan garam.
Gugus polar seperti gugus hidroksil dan amida adalah dipol: mereka memiliki kelebihan elektron pada satu atom dan kekurangan kompensasi pada atom lainnya. Muatan parsial dipol akan tertarik ke dipol lain dan ke ion bermuatan penuh.
Pasukan van der Wall:
Ini adalah interaksi jarak dekat yang relatif lemah antara atom. Bentuk-bentuk ini penting dalam interior protein-dan membran dan dalam pengikatan spesifik suatu ligan ke tempat pengikatannya.
Interaksi hidrofobik:
Sebuah polipeptida dengan residu hidrofilik dan hidrofobik akan secara spontan mengadopsi konfigurasi di mana residu hidrofobik tidak terkena air, baik dengan duduk di lipid bilayer atau dengan mengadopsi bentuk bulat di mana residu hidrofobik bersembunyi di tengah protein.
Ikatan disulfida:
Protein ekstra seluler sering memiliki ikatan disulfida antara residu sistein tertentu. Ini cenderung mengunci molekul ke dalam konformasinya. Beberapa protein mengandung ikatan disulfida. Tapi ini lebih stabil.



