Unit Dasar Imunoglobulin – Rantai Berat dan Rantai Ringan!
Immunoglobulin adalah molekul simetris bilateral yang terdiri dari empat rantai polipeptida (Gambar 9.2).
Dua rantai polipeptida disebut rantai berat dan dua rantai lainnya disebut rantai ringan.
Rantai Berat dan Rantai Ringan:
Dua rantai polipeptida yang lebih besar disebut rantai berat (H) dan dua rantai yang lebih kecil disebut rantai ringan (L). Dua rantai berat dalam molekul imunoglobulin identik. Demikian pula dua rantai ringan dalam imunoglobulin adalah identik. Keempat rantai polipeptida ini disatukan oleh gaya non kovalen dan jembatan disulfida interchain kovalen.
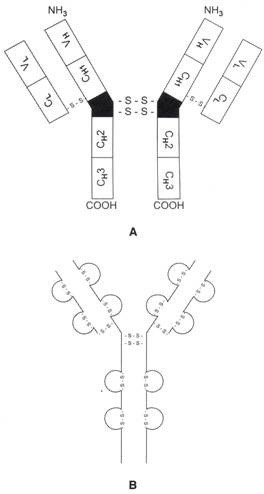
Gambar 9.2A dan B: Struktur dasar empat rantai imunoglobulin.
( A ) Diagram skema struktur dasar 4 rantai, ( B ) Diagram skema rantai berat dan rantai ringan pada Immunoglobulin. Asam amino terlipat menjadi domain. Setiap domain terdiri dari sekitar 110 asam amino dan ikatan disulfida intrachain
Setiap polipeptida rantai berat dan ringan dilipat menjadi wilayah globular, yang disebut domain. Setiap domain mungkin memiliki 100 hingga 110 asam amino dan satu ikatan disulfida intrachain. Rantai berat memiliki 4 atau 5 domain, sedangkan rantai ringan memiliki 2 domain.
Wilayah Imunoglobulin Konstan dan Variabel:
Di antara molekul imunoglobulin yang berbeda, urutan asam amino dalam domain N-terminal sangat bervariasi, dan karenanya domain N-terminal disebut wilayah variabel, disingkat V H atau V L (V H – wilayah variabel dalam rantai berat; wilayah variabel VL dalam rantai ringan). Di sisi lain, urutan asam amino dalam domain yang tersisa relatif konstan dan karenanya disebut wilayah konstan, disingkat C H atau C L (C H -wilayah konstan rantai berat; wilayah konstanta CL rantai ringan).
Rantai ringan imunoglobulin memiliki satu wilayah konstan dan satu variabel. Rantai berat memiliki satu wilayah variabel (V H ) dan 3 atau 4 wilayah konstan (C H 1, C H 2, C H 3, C H 4) dimulai dengan domain di sebelah V H .
Imunoglobulin memiliki konfigurasi keseluruhan berbentuk ‘Y’ jika dilihat secara skematis. Rantai berat dan ringan disejajarkan secara paralel. Satu domain VH terletak tepat di samping domain VL dan pasangan ini ( VH dan VL ) bersama-sama membentuk situs pengikatan antigen tunggal. Pasangan domain VH dan VL lainnya membentuk situs pengikatan antigen lain.
Jadi satu imunoglobulin memiliki dua tempat pengikatan antigen. Oleh karena itu, imunoglobulin dikatakan divalen sehubungan dengan pengikatan antigen. Selain itu, kedua tempat pengikatan antigen dalam imunoglobulin adalah identik sehubungan dengan spesifisitas antigennya, (yakni kedua tempat pengikatan antigen dari molekul imunoglobulin berikatan dengan antigen yang serupa).
Situs pengikatan antigen imunoglobulin berada di wilayah variabel. Pengikatan imunoglobulin dengan antigen adalah peristiwa utama, yang akan mengarah pada eliminasi akhir antigen.
Immunoglobulin bergabung hanya dengan antigen yang memicu produksinya dan tidak bergabung dengan antigen lain. Ini disebut sebagai spesifisitas antigen imunoglobulin. Spesifisitas antigen imunoglobulin ditentukan oleh sekuens gabungan situs pengikatan antigennya dalam domain VH dan VL .
Variasi urutan penambahan amino di wilayah variabel memungkinkan inang untuk membuat imunoglobulin yang berbeda untuk bergabung dengan antigen yang berbeda. Karenanya inang dapat melindungi dirinya dari berbagai antigen yang masuk ke dalam tubuh.
Daerah Engsel:
Daerah engsel adalah segmen pendek yang terletak di antara domain C H 1 dan C H 2. Daerah engsel terutama terdiri dari sistein dan prolin. Ikatan disulfida rantai antar berat terbentuk antara residu sistein dari dua rantai berat. Wilayah ini lebih rentan terhadap serangan enzimatik. Rantai asam amino di daerah engsel memiliki struktur sekunder yang longgar, yang memungkinkan kedua lengan (berisi tempat pengikatan antigen) imunoglobulin bergerak relatif bebas terhadap satu sama lain.
Rantai J:
Unit dasar empat rantai imunoglobulin disebut monomer. Jika suatu imunoglobulin memiliki lebih dari satu unit dasar, ia disebut polimer (Gambar 9.3) (dimer = dua unit dasar; pentamer = lima unit dasar).
saya. Imunoglobulin permukaan pada sel B selalu bersifat monomer.
- Imunoglobulin yang disekresikan dalam cairan tubuh milik kelas IgG, IgD dan IgE juga merupakan monomer.
aku aku aku. IgM dan IgA dalam cairan tubuh umumnya ada sebagai polimer dari unit empat rantai dasar.
Dipercaya bahwa rantai polipeptida tambahan yang disebut rantai J (MW 15.000) membantu dalam polimerisasi IgA dan IgM.
Daerah Hipervariabel Immunoglobulin:
Domain terminal-N dari rantai imunoglobulin berat (V H ) dan rantai ringan (V L ) disebut daerah variabel. Domain wilayah variabel terdiri dari sekitar 110 urutan asam amino. Meskipun disebut wilayah variabel, urutan asam amino di seluruh domain tidak bervariasi. Variabilitas ekstrim dari urutan hanya terjadi pada bentangan tertentu yang disebut daerah hipervariabel atau daerah penentu komplementaritas (CDR). Setiap wilayah variabel memiliki tiga CDR (CDR1, CDR2 dan CDR3) dan CDR panjangnya sekitar 9-12 asam amino. CDR di daerah hipervariabel dipisahkan oleh rentang urutan yang relatif invarian yang disebut daerah kerangka (panjang 15-30 asam amino) (Gambar 9.4).
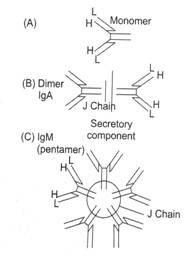
Gambar 9.3A sampai C: Diagram skematik monomer imunoglobulin, dimer dan pentamer.
(A) Dua rantai berat identik dan dua rantai ringan identik bersama-sama membentuk unit dasar imunoglobulin, yang dikenal sebagai monomer, (B) Molekul imunoglobulin yang terdiri dari dua unit dasar (atau dua monomer) yang dihubungkan bersama oleh rantai J disebut dimer, dan (C) Molekul imunoglobulin yang terdiri dari lima unit dasar (atau lima monomer) disebut pentamer
Pengikatan antigen terutama melibatkan asam amino di wilayah hipervariabel. Oleh karena itu sekuens di daerah hipervariabel terutama menentukan spesifisitas antigen. Situs pengikatan antigen tunggal dibentuk oleh oposisi dari enam loop variabel hipervariabel (yaitu tiga dari rantai VH dan tiga lainnya dari rantai VL ).
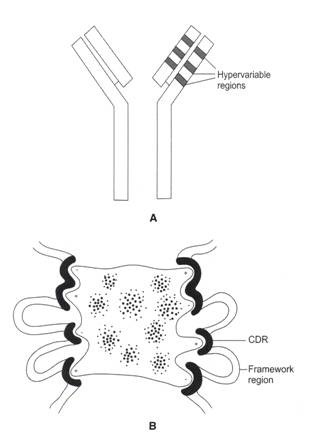
Gambar 9.4A dan B: Diagram skematis wilayah hipervariabel.
(A) Domain N-terminal rantai berat dan rantai ringan imunoglobulin disebut wilayah variabel. Setiap wilayah variabel rantai berat dan rantai ringan terdiri dari 110 asam amino. Seluruh urutan asam amino di wilayah variabel tidak bervariasi. Variabilitas ekstrim dari sekuens hanya terjadi pada bentangan pendek sekuens tertentu yang disebut daerah hipervariabel atau daerah penentu komplementaritas (CDR), (B) Ada tiga CDR (CDR1, CDR2, dan CDR3) di setiap rantai. Setiap CDR panjangnya sekitar 9-12 asam amino. CDR dipisahkan dari masing-masing oleh bentangan urutan yang relatif invarian yang disebut wilayah kerangka kerja. Setiap wilayah kerangka terdiri dari sekitar 15-30 asam amino.
Jembatan Disulfida:
Jembatan disulfida dalam molekul Ig diperlukan untuk menjaga hubungan empat rantai polipepfida.
saya. Rantai H dan L dalam Ig disatukan oleh ikatan disulfida antar rantai.
- Ikatan disulfida interchain menahan dua rantai H bersama-sama dalam imunoglobulin. Jumlah ikatan disulfida antara dua rantai H bervariasi pada kelas imunoglobulin yang berbeda, (misalnya IgGl manusia memiliki dua jembatan dan IgG3 memiliki lima belas jembatan.)
aku aku aku. Juga sejumlah jembatan disulfida ada dalam setiap rantai imunoglobulin. Jembatan disulfida dalam rantai ini disebut jembatan intrachain.



