Baca artikel ini untuk mempelajari tentang uji hidrolisis lipid, untuk mengetahui kemampuan bakteri dalam menghidrolisis lipid (lemak)!
Prinsip:
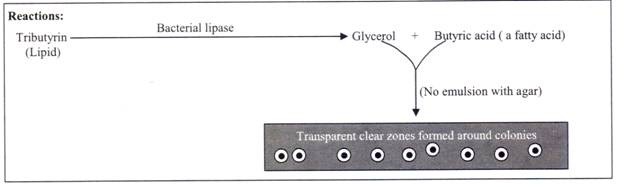
Beberapa bakteri memiliki kemampuan untuk menghidrolisis lipid (lemak) menjadi gliserol dan asam lemak, karena mereka memiliki ‘lipase’ enzim lipolitik.
Bakteri ini disebut bakteri lipolitik. Sementara lipid membentuk emulsi, ketika disalurkan dalam agar, menghasilkan opasitas, produk akhir terhidrolisisnya, gliserol dan asam lemak, tidak membentuk emulsi tersebut dengan agar, yang tidak menghasilkan opasitas tersebut; justru menghasilkan transparansi.
Pada uji hidrolisis lipid, bakteri uji ditumbuhkan pada pelat agar yang mengandung tributirin sebagai substrat lipid. Tributyrin membentuk emulsi, ketika disalurkan dalam agar, menghasilkan media buram.
Jika bakteri memiliki kemampuan untuk menghidrolisis lipid, koloninya menghidrolisis tributirin dalam medium di area sekitarnya menjadi gliserol larut dan asam lemak (asam butirat), sedangkan area lempeng lainnya mengandung tributirin yang tidak terhidrolisis.
Akibatnya, zona bening transparan terbentuk di sekitar koloni, karena produk terhidrolisis, gliserol dan asam lemak, yang terbentuk di sekitarnya tidak membentuk emulsi dengan agar. Di sisi lain, sisa bidang pelat tetap buram, karena tributirin yang tidak terhidrolisis di daerah ini membentuk emulsi dengan agar.
Bahan yang Dibutuhkan:
Cawan petri, labu berbentuk kerucut, sumbat kapas, loop inokulasi, autoklaf, pembakar bunsen, ruang aliran laminar, tabung pembuangan, inkubator, agar tributyrin, koloni terisolasi atau biakan murni bakteri.
Prosedur:
- Dua cawan petri dibersihkan, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang (Gambar 7.22). Langkah ini serta sterilisasi cawan petri pada langkah 6 dihilangkan, jika cawan petri yang disterilkan dengan oven digunakan secara langsung.
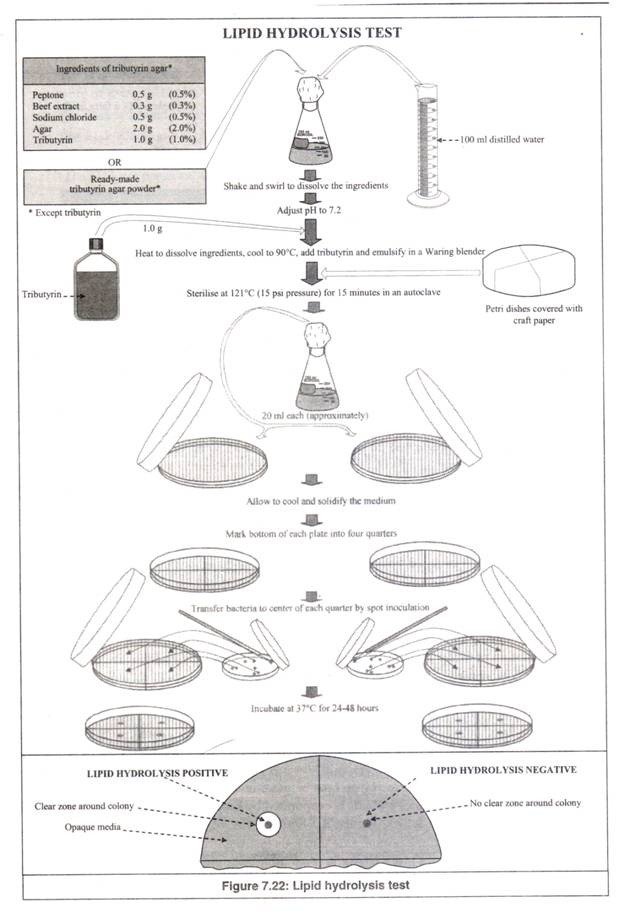
- Bahan media tributyrin agar (tidak termasuk tributyrin, yang merupakan komponen lipid) atau bubuk siap pakai yang diperlukan untuk 100 ml media ditimbang dan dilarutkan dalam 100 ml air suling dalam labu berbentuk kerucut 250 ml dengan cara dikocok dan berputar-putar.
- Ditentukan pH-nya menggunakan kertas pH atau pH meter dan diatur menjadi 7,2 menggunakan HCI 0,1N jika lebih atau menggunakan NaOH 0,1N jika kurang.
- Labu dipanaskan untuk melarutkan agar-agar dalam media secara sempurna.
- Setelah didinginkan hingga sekitar 90°C, tributyrin ditambahkan dan diemulsi dalam Warring blender.
- Labu ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Dua cawan petri dan labu berbentuk kerucut berisi media agar tributirin disterilkan pada suhu 121 °C (tekanan 15 psi) selama 15 menit dalam autoklaf.
- Setelah sterilisasi, dikeluarkan dari autoklaf dan dibiarkan dingin beberapa saat, tanpa membiarkan media mengeras. Pendinginan medium mencegah kondensasi dan akumulasi tetesan air di dalam pelat. Jika media telah disiapkan dan dipadatkan selama penyimpanan, maka harus dicairkan dengan cara dipanaskan secara hati-hati sampai benar-benar meleleh.
- Untuk menyiapkan pelat agar tributirin, sebelum media agar tributirin yang disterilkan mendingin dan memadat, dalam kondisi cair yang hangat, dituangkan secara aseptis, sebaiknya di dalam ruang aliran laminar, ke dalam dua cawan petri yang disterilkan (masing-masing sekitar 20 ml), sehingga media cair menutupi bagian bawah cawan petri sepenuhnya.
Kemudian, pelat ditutup dengan tutupnya dan dibiarkan dingin, untuk memadatkan media di dalamnya. Tributyrin membentuk emulsi, ketika disalurkan dalam agar, menghasilkan media buram. Uap air yang mungkin mengembun pada permukaan bagian dalam pelat dan tutup diuapkan dengan menjaga pelat dan tutup dalam posisi terbalik di dalam inkubator pada suhu 37°C selama kurang lebih 1 jam.
- Setiap lempeng diberi tanda di sisi bawah menjadi empat bagian.
- “Spot inoculation” bakteri uji dilakukan secara aseptis, sebaiknya di dalam ruang aliran laminar, di tengah setiap kuartal dengan membuat noda (atau apusan kecil) bakteri dengan bantuan loop yang disterilkan dengan api. Loop disterilkan setelah setiap inokulasi.
- Pelat yang telah diinokulasi diinkubasi dengan posisi terbalik, dari atas ke bawah, pada suhu 37°C selama 24 sampai 48 jam dalam inkubator sampai terlihat koloni bakteri.
Pengamatan:
- Terbentuk zona bening transparan di sekitar koloni bakteri: hidrolisis lipid positif.
- Zona bening transparan tidak terbentuk di sekitar koloni bakteri: Hidrolisis lipid negatif.



