Bertujuan untuk mengisolasi bakteri berbeda yang ada dalam sampel tertentu dan mempertahankan kultur murninya.
Tujuan:
Bakteri yang ditemukan di alam, tidak muncul sebagai spesies yang terpisah, melainkan muncul sebagai populasi campuran dari spesies yang berbeda.
Oleh karena itu, untuk mempelajari masing-masing spesies bakteri, pertama-tama mereka harus dipisahkan dari populasi campuran. Proses ini disebut ‘isolasi bakteri’.
Ini dilakukan dengan menumbuhkan populasi campuran bakteri pada permukaan media padat menjadi koloni terpisah. ‘Koloni’ adalah individu, massa bakteri yang terlihat secara makroskopis yang tumbuh di permukaan media padat, masing-masing mewakili perbanyakan satu bakteri.
Karena setiap koloni berasal dari pertumbuhan dan perbanyakan berulang dari satu bakteri, semua bakteri yang ada di koloni itu berasal dari spesies yang sama. Jadi, setiap koloni mewakili populasi yang sangat besar dari satu spesies bakteri.
Koloni-koloni ini dipindahkan secara aseptik ke agar miring nutrisi terpisah dan dibiarkan tumbuh di sana. Spesies bakteri yang diisolasi, ditumbuhkan secara terpisah pada agar miring disebut ‘kultur murni’. Setiap 15 hingga 30 hari, mereka dipindahkan ke lereng segar, sehingga tidak kehilangan karakteristik aslinya karena terlalu padat, kekurangan nutrisi, dan akumulasi metabolit.
Dengan cara ini, biakan bakteri murni dipertahankan di laboratorium dengan pemindahan berulang ke miring segar secara berkala. Proses ini dikenal sebagai ‘pemeliharaan budaya murni’. Kultur murni dipelihara di laboratorium untuk identifikasi selanjutnya dengan berbagai teknik pewarnaan, biokimia, serologi dan molekuler serta untuk penggunaan masa depan.
‘Kultur stok’ adalah kultur murni standar, yang identifikasinya telah ditetapkan secara internasional untuk tingkat genus, spesies, sub-spesies, tipe, atau sub-tipe. Mereka dipelihara di laboratorium mikrobiologi yang diakui secara internasional.
Laboratorium lain dapat memperolehnya dari laboratorium ini dan memeliharanya di laboratorium mereka sendiri sebagai biakan stok mereka, dengan pemindahan berulang ke lereng baru secara berkala. Mereka digunakan untuk identifikasi kultur murni yang diperoleh di laboratorium ini dengan membandingkan karakteristiknya dengan kultur stok standar.
Prinsip:
Populasi campuran bakteri yang ada dalam bahan tertentu (padat, cair atau permukaan) ditumbuhkan pada pelat agar nutrisi dengan metode pelat sebar atau pelat gores seperti yang dijelaskan sebelumnya di bawah ‘Budidaya bakteri’. Setiap koloni terisolasi yang ditemukan pada lempeng agar terdiri dari satu spesies bakteri, karena setiap koloni tumbuh dari satu bakteri.
Dengan demikian, bakteri diisolasi pada cawan agar dengan dua teknik sebagai berikut:
(a) Teknik pelat sebar
(b) Teknik pelat coretan
Koloni representatif (koloni yang memiliki karakteristik berbeda) dipilih dan diinokulasi secara aseptik untuk memisahkan agar miring untuk mendapatkan biakan murni. Setelah setiap 15 sampai 30 hari, mereka dipindahkan ke miring segar untuk pemeliharaan biakan murni ini.
Bahan yang Dibutuhkan:
Tabung reaksi (5 no.), 250 ml labu berbentuk kerucut (1 no), 0,1 N NaOH, 0,1 N HCI, air suling, agar nutrisi, kapas non-penyerap, loop, kertas kerajinan, benang (atau karet gelang), kertas pH (atau pH meter), pembakar bunsen, autoklaf, ruang aliran laminar, inkubator, pelat yang berisi koloni bakteri yang diisolasi (pelat sebar atau pelat gores).
Prosedur:
- Bahan-bahan media nutrien agar atau bubuk siap pakai yang diperlukan sebanyak 100 ml media ditimbang dan dilarutkan dalam 100 ml air suling dalam labu berbentuk kerucut 250 ml dengan cara dikocok dan diaduk (Gambar 6.4).
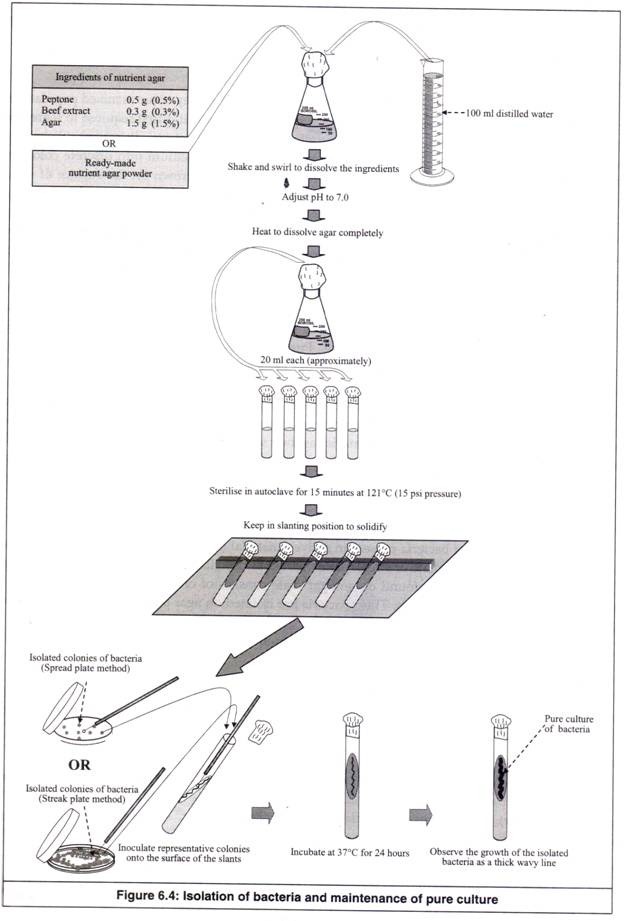
- Ditentukan pH-nya menggunakan kertas pH atau pH meter dan diatur menjadi 7,0 menggunakan HC1 0,1N jika lebih banyak atau menggunakan NaOH 0,1N jika lebih sedikit.
- Labu dipanaskan untuk melarutkan agar-agar dalam media secara sempurna.
- Sebelum memadat, media dalam keadaan cair hangat disebarkan ke dalam 5 tabung reaksi (masing-masing kurang lebih 20 ml).
- Tabung reaksi ditutup dengan kapas, ditutup dengan kertas kerajinan dan diikat dengan benang atau karet gelang.
- Disterilkan pada suhu 121°C (tekanan 15 psi) selama 15 menit dalam autoklaf.
- Setelah sterilisasi, dikeluarkan dari autoklaf dan disimpan dalam posisi miring untuk mendinginkan dan memadatkan media. Tabung-tabung reaksi yang berisi media agar nutrisi yang dipadatkan dalam kondisi miring ini disebut ‘nutrient agar miring’.
- Langkah 10 dan 11 harus dilakukan mengikuti teknik aseptik sebaiknya dalam ruang aliran laminar. Mulut wadah yang berisi media atau biakan yang disterilkan harus diperlihatkan di atas api pembakar bunsen setelah melepas sumbat kapas dan sebelum meletakkannya kembali.
Loops, sebelum digunakan harus disterilkan di atas api dengan cara dipanaskan sampai merah membara lalu didinginkan selama 30 detik hingga dingin hingga suhu kamar. Mereka tidak boleh digunakan saat sangat panas, karena mereka membunuh mikroba saat menyentuhnya.
- Pada percobaan sebelumnya, jika koloni yang diisolasi dapat diamati pada spread plate atau streak plate, dipilih lima koloni dengan karakteristik yang berbeda sebagai perwakilan koloni.
- Sebuah ose disterilkan di atas api dan ose bakteri dari masing-masing perwakilan koloni diambil secara aseptik. Lengkung dimasukkan ke dalam agar miring, sehingga lengkung bakteri masuk ke ujung agar miring. Loop digerakkan ke luar secara bergelombang menyentuh permukaan bidang miring, sehingga terbentuk garis bergelombang.
- Gelung tersebut disterilkan dengan api dan dengan cara yang sama empat koloni perwakilan lainnya diinokulasi secara terpisah ke empat lereng kiri. Loop disterilkan setelah setiap inokulasi.
- Lima slant yang telah diinokulasi diinkubasi pada suhu 37°C selama 24 jam dalam inkubator.
Pengamatan (Karakteristik Budaya):
(i) Garis Bergelombang dengan Pertumbuhan Sepanjang Panjangnya Teramati:
Pertumbuhan telah terjadi.
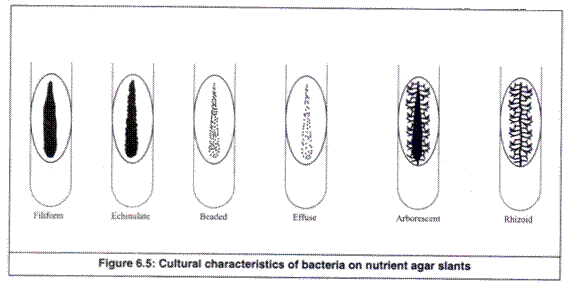
Kemiringan diamati untuk ciri-ciri kemiringan sebagai berikut (Gambar 6.5).
- Kelimpahan Pertumbuhan:
Jumlah pertumbuhan ditetapkan sebagai tidak ada, sedikit, sedang atau besar.
- Pigmentasi:
Mikroorganisme kromogenik dapat menghasilkan pigmen intraseluler yang bertanggung jawab atas pewarnaan organisme seperti yang terlihat pada koloni permukaan. Organisme lain menghasilkan pigmen larut ekstraseluler yang diekskresikan ke dalam media dan juga menghasilkan warna. Akan tetapi, sebagian besar organisme bersifat non-kromomerik dan akan tampak putih hingga abu-abu.
- Karakteristik Optik:
Karakteristik optik dapat dievaluasi berdasarkan jumlah cahaya yang ditransmisikan melalui pertumbuhan.
Karakteristik ini digambarkan sebagai:
(sebuah) Buram: Tidak ada transmisi cahaya.
(b) Tembus: Transmisi cahaya sebagian.
(c) Transparan: Transmisi cahaya penuh.
- Formulir:
Penampakan garis pertumbuhan tunggal pada permukaan agar-agar ditunjukkan sebagai berikut:
(sebuah) Filiform: Pertumbuhan terus menerus seperti benang dengan tepi halus.
(b) Echinulat: Pertumbuhan terus-menerus seperti benang dengan tepi tidak beraturan.
(c) Manik-manik: Koloni non-konfluen hingga semi-konfluen.
(d) Effuse: Tipis, pertumbuhan menyebar.
(e) Arborescent: Pertumbuhan seperti pohon.
(f) Rhizoid: pertumbuhan seperti akar.
(ii) Tidak Ada Pertumbuhan Sepanjang Garis Inokulasi:
Kesalahan teknik inokulasi, Inokulasi diulangi C Enumerasi Bakteri.
C. Pencacahan Bakteri:
Tingkat aktivitas bakteri dalam sampel tertentu dalam serangkaian kondisi tertentu terutama bergantung pada jumlah total bakteri yang ada di dalamnya terlepas dari spesiesnya. Oleh karena itu, sangat sering diperlukan untuk mengetahui jumlah total bakteri yang ada dalam sampel makanan, air, tanah, udara, dan jaringan selama analisis mikrobiologisnya.
Memperkirakan jumlah bakteri dalam sampel tertentu disebut ‘pencacahan bakteri’. Ada berbagai metode pencacahan bakteri seperti yang diberikan di bawah ini. Semua metode ini membutuhkan bakteri untuk hadir dalam suspensi homogen.
Oleh karena itu sampel cair diasumsikan sebagai suspensi bakteri yang homogen dan langsung digunakan, sedangkan sampel padat dihomogenkan dalam larutan garam steril, sehingga diperoleh suspensi bakteri yang homogen.
Tidak digunakan secara umum:
(I) Metode Langsung:
(a) Jumlah mikroskopis langsung
(b) Penghitung sel elektronik
(II) Metode Tidak Langsung:
(c) Metode kimia
(d) metode turbidimetri
(e) Jumlah filter membran
Paling banyak digunakan:
(f) Metode pelapisan pengenceran-agar berseri atau Metode Total Plate Count (metode TPC)
(a) Hitung Mikroskopik Langsung:
Dalam metode ini, jumlah bakteri yang terdapat dalam alikuot suspensi homogen bakteri dihitung secara langsung di bawah mikroskop dan jumlah total bakteri dalam sampel ditentukan secara matematis.
Keuntungan dari metode ini adalah sangat cepat. Kelemahannya adalah, baik sel hidup (layak) maupun sel mati dihitung dan metode ini tidak sensitif terhadap populasi kurang dari satu juta bakteri per mililiter.
Penghitungan dapat dilakukan dengan dua cara sebagai berikut:
(i) Bilik Petroff-Hauser:
Ini adalah ruang hitung khusus, di mana alikuot dari suspensi bakteri yang homogen dimasukkan untuk dihitung langsung di bawah mikroskop.
(ii) Smear Breed:
Sel bakteri dihitung langsung di bawah mikroskop menggunakan apusan bernoda yang dibatasi pada area seluas 1 mm 2 pada slide. Ini terutama digunakan untuk pencacahan bakteri dalam susu.
(b) Penghitung Sel Elektronik:
Penghitung sel elektronik seperti ‘Coulter counter’ digunakan untuk menghitung jumlah sel bakteri secara langsung. Suspensi homogen dari sel-sel bakteri yang disiapkan dalam cairan konduksi dibiarkan melewati lubang kecil, di mana arus listrik mengalir.
Hambatan pada orifice dicatat secara elektronik. Ketika sebuah sel melewati lubang, menjadi non-konduktor, itu meningkatkan resistensi sesaat. Berapa kali resistensi meningkat sesaat dicatat secara elektronik, yang menunjukkan jumlah bakteri yang ada dalam suspensi.
Keuntungan dari metode ini adalah sangat cepat. Kerugiannya adalah, baik sel hidup (layak) dan sel mati dihitung dan instrumen tidak dapat membedakan antara sel bakteri dan partikel inert.
(c) Metode Kimia:
Metode ini memperkirakan jumlah zat tersebut, terutama bahan kimia, yang meningkat seiring dengan peningkatan populasi bakteri.
Parameter utama yang diperkirakan adalah sebagai berikut:
(i) Konsentrasi protein
(ii) konsentrasi DNA
(iii) Berat kering
(iv) Produksi karbon dioksida
(v) Penyerapan oksigen
(vi) Produksi asam laktat
(d) Metode Turbidimetri:
Ketika bakteri ditumbuhkan dalam media cair yang kaya nutrisi (misalnya kaldu nutrisi), pertumbuhannya yang banyak membuat media menjadi keruh, karena sebagian besar sel bakteri tetap tersuspensi di dalamnya. Kekeruhan meningkat dengan bertambahnya jumlah sel dalam media. Saat kekeruhan meningkat, ‘absorbansi’ atau ‘densitas optik (OD)’ media meningkat.
OD suspensi sel bakteri dalam media diukur menggunakan spektrofotometer pada 600 nm. Jumlah sel bakteri dalam suspensi diketahui dengan membandingkan OD dengan kurva standar yang dibuat dengan memplot nilai OD untuk berbagai konsentrasi bakteri yang diketahui. Metodenya cepat, tetapi terbatas pada suspensi bakteri lebih dari 10 juta sel.
(e) Jumlah Filter Membran:
Metode ini digunakan, bila jumlah bakteri dalam sampel cair sangat sedikit. Untuk meningkatkan konsentrasi bakteri, terlebih dahulu sampel cairan disaring secara aseptik melalui alat penyaring membran yang telah disterilkan dengan menggunakan penyaring membran steril.
Filter membran yang mengandung bakteri yang terperangkap dipindahkan secara aseptik ke cawan petri steril yang berisi bantalan penyerap yang dijenuhkan dengan media cairan diferensial selektif. Media merembes ke permukaan filter. Setelah inkubasi, jumlah koloni yang terbentuk pada filter dihitung dengan menggunakan mikroskop sederhana.
(f) Metode Pelapisan Agar-Pengenceran Serial atau Metode TPC:
Ini adalah metode yang paling serbaguna dan banyak digunakan untuk pencacahan bakteri.



