Bereksperimenlah melakukan pewarnaan tahan asam pada bakteri untuk mengetahui apakah bakteri tersebut tahan asam atau tidak!
Tujuan:
Sebagian besar bakteri dapat diwarnai, baik dengan pewarnaan dasar sederhana atau dengan pewarnaan gram, karena sel-selnya mudah ternoda.
Namun, beberapa bakteri memiliki dinding sel lilin tebal yang terbuat dari bahan lipid.
Bakteri semacam itu sangat sulit untuk diwarnai, karena noda air biasa tidak dapat masuk ke dalam selnya dengan mudah, tetapi setelah diwarnai; sama sulitnya untuk menghilangkan noda dari sel mereka, bahkan dengan penggunaan asam-alkohol yang kuat sebagai agen penghilang warna. Bakteri ini diwarnai dengan pewarnaan tahan asam.
Jadi, pewarnaan tahan asam, mirip dengan pewarnaan gram, adalah metode pewarnaan diferensial, yang membedakan bakteri, berdasarkan sifat dinding selnya, menjadi dua kelompok sebagai berikut:
(1) Bakteri Tahan Asam:
Bakteri, yang sangat sulit untuk diwarnai, tetapi sekali diwarnai, sama sulitnya untuk menghilangkan noda dari selnya, bahkan dengan penggunaan asam-alkohol yang kuat sebagai agen penghilang warna, adalah bakteri tahan asam (asam-mencintai bakteri).
Contoh: Mycobacterium spp. [M. tuberculosis (bakteri TBC), M. leprae (bakteri kusta), M. smegmatis (bakteri alami smegma) dan M. marinum (bakteri TBC ikan laut). Mereka memiliki dinding sel lilin tebal yang terbuat dari bahan lipid.
(2) Bakteri tidak tahan asam:
Bakteri yang mudah diwarnai dan juga mudah didekolorisasi oleh asam-alkohol sebagai agen penghilang warna merupakan bakteri yang tidak tahan asam (non-acid-loving bacteria). Contoh: Semua bakteri kecuali Mycobacterium spp. Pada bakteri ini, dinding selnya tidak tebal dan berlilin.
Pewarnaan tahan asam berguna dalam membedakan bakteri tahan asam dan tidak tahan asam dan juga dalam identifikasi bakteri yang termasuk dalam genus Mycobacterium.
Prinsip:
Bakteri tahan asam berbeda dengan bakteri tidak tahan asam karena mereka memiliki dinding sel lilin tebal yang terbuat dari bahan lipid. Noda berair biasa, seperti biru metilen atau ungu kristal tidak dapat masuk ke dalam sel mereka melalui dinding sel lilin ini.
Namun, karbol fuchsin pewarna fenolik primer berwarna merah (asam karbolat atau fenol + basa fuchsin); yang larut dalam bahan lipid dari dinding sel, dapat masuk ke dalam sel mereka melalui dinding sel dan dapat dipertahankan di dalam sel memberikan warna merah kepada mereka.
Penetrasi selanjutnya ditambah dengan penerapan panas, yang mendorong fuchsine karbol melalui dinding lipoid ke dalam sitoplasma. (Modifikasi kecil dari metode Ziel-Neelsen ini menjelaskan penambahan zat pembasah, Turgitol, ke noda, yang mengurangi tegangan permukaan antara dinding sel dan noda, sehingga tidak memerlukan pemanasan). Sel dibiarkan mendingin, sehingga mengeraskan dinding sel berlilin.
Ketika sel terkena zat penghilang warna, asam-alkohol, mereka menolak penghilangan warna, karena noda primer lebih mudah larut dalam lilin seluler daripada zat penghilang warna. Selanjutnya, ketika diwarnai dengan metilen biru, ia tidak dapat masuk ke dalam sel melalui dinding sel berlilin.
Dengan demikian, akhirnya bakteri tahan asam mempertahankan warna merah dari noda primer dan tampak merah. Di sisi lain, bakteri non-tahan asam mengambil noda primer dengan mudah dan mengalami dekolorisasi dengan mudah. Ketika diwarnai dengan biru metilen, sel-sel tak berwarna ini juga dengan mudah menyerap noda balik dan tampak biru, tidak seperti bakteri tahan asam, yang tampak merah.
Bahan yang Dibutuhkan:
Slide, loop, pewarna primer (carbol fuchsine), agen penghilang warna (acid-alcohol), counter stain (methylene blue), hot plate, kultur bakteri broth/slant/plate, mikroskop, minyak imersi.
Prosedur:
- Slide dibersihkan dengan benar di bawah air ledeng, sehingga air tidak tertinggal sebagai tetesan di permukaannya (Gambar 5.12).
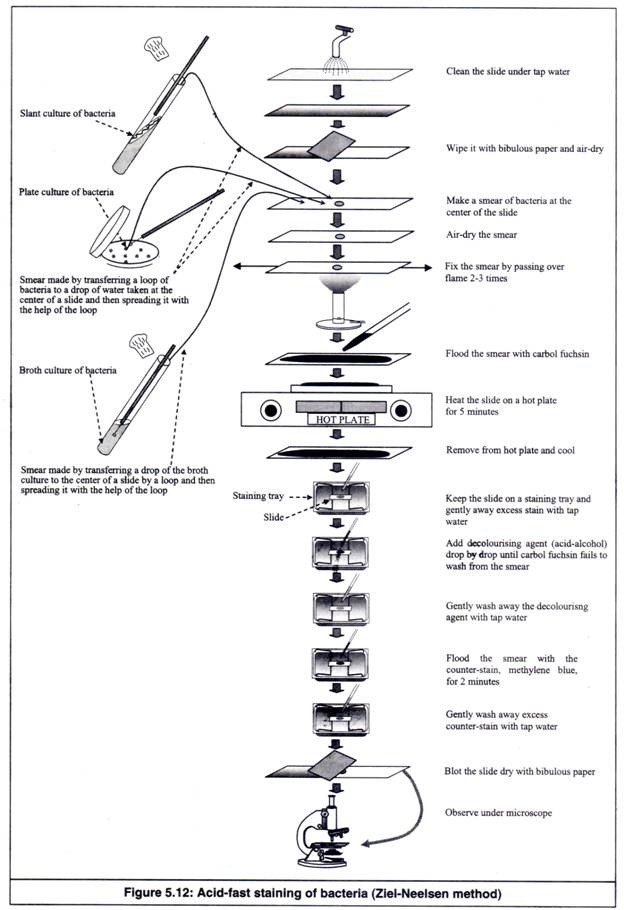
- Air yang menempel diseka dengan kertas bibulous dan slide dikeringkan dengan udara.
- Apusan bakteri disiapkan di tengah kaca objek dengan dua metode sebagai berikut.
(a) Jika bakteri yang ditumbuhkan pada cawan agar atau agar miring akan diamati, setetes air diletakkan di tengah kaca objek dan ose bakteri dari cawan atau slant dipindahkan ke sana dengan ose yang disterilkan di atas nyala api . Kemudian, dengan memutar loop secara perlahan pada tetesan, suspensi bakteri dibuat dan disebarkan hingga diperoleh apusan.
(b) Jika bakteri yang tumbuh dalam kaldu cair akan diamati, setetes suspensi bakteri ditempatkan langsung di tengah kaca objek dengan ose yang disterilkan dengan api dan apusan dibuat dengan menyebarkannya.
- Apusan dikeringkan dengan udara.
- Apusan difiksasi dengan pemanasan. Pemanasan menghasilkan koagulasi protein seluler, yang menyebabkan sel menempel pada permukaan slide dan tidak hanyut selama pewarnaan. Heat-fixation dilakukan dengan melewatkan slide secara cepat di atas nyala api sebanyak 2-3 kali, dengan permukaan smear menghadap ke atas, sehingga smear tidak memanas.
- Apusan dibanjiri karbol fuchsin
- Slide diletakkan di atas hot plate hangat, biarkan preparat menguap selama 5 menit. Suhu hot plate diatur sedemikian rupa sehingga sediaan tidak mendidih dan cepat menguap. Kehilangan penguapan diisi kembali, sehingga apusan tidak mengering. (Untuk metode tanpa panas, apusan digenangi selama 3-5 menit dengan carbol fuchsin yang mengandung Turgitol).
- Slide dikeluarkan dari hot plate dan didinginkan.
- Noda berlebih dibersihkan dari apusan di bawah air keran yang mengalir lembut, sedemikian rupa sehingga air tidak jatuh langsung ke apusan.
- Zat penghilang warna, asam-alkohol, ditambahkan pada apusan tetes demi tetes, sampai karbol fuchsin tidak dapat dibersihkan dari apusan.
- Asam-alkohol dibersihkan dari apusan di bawah air keran yang mengalir dengan lembut, sedemikian rupa sehingga air tidak jatuh langsung ke apusan.
- Apusan digenangi dengan counter-stain, methylene blue, selama 2 menit.
- Counter-stain yang berlebih dibersihkan dari smear di bawah air keran yang mengalir dengan lembut, sedemikian rupa sehingga air tidak jatuh langsung ke smear.
- Slide dikeringkan dengan kertas bibulous.
- Slide dijepitkan ke panggung mikroskop dan apusan diamati dengan daya rendah dan objektif kering tinggi.
- Setetes minyak imersi dioleskan pada apusan.
- Apusan diamati dengan objektif oil-immersion.
Pengamatan (Under Oil-immersion Objective):
- Warna sel:
Merah: Tahan asam
Biru: Tidak tahan asam
- Bentuk bakteri:
Bulat (coccus)
Berbentuk batang (basil)
Seperti koma (vibrio)
Spiral (spirocheta)
- Susunan bakteri:
Berpasangan (diplobacillus / diplococcus)
Dalam empat (tetrad)
Berantai (streptococcus/streptobacillus)
Cluster seperti anggur (staphylococcus)
Kuboid (sarcinae atau oktet)
- Ukuran bakteri:
Dengan perkiraan mata, buatlah gambar bidang di bawah tujuan perendaman minyak.



