Bertujuan untuk melakukan uji motilitas suatu bakteri, dengan sediaan tetes gantung, untuk mengetahui apakah bakteri tersebut motil atau non-motil.
Tujuan:
Motilitas berarti kemampuan bergerak dengan kekuatan sendiri. Berdasarkan motilitasnya, bakteri dapat dibedakan menjadi dua kelompok sebagai berikut.
(1) Bakteri Motil:
Bakteri, yang memiliki kemampuan intrinsik untuk bergerak di media sekitarnya, di mana ia tetap tersuspensi, adalah bakteri motil.
(2) Bakteri Non-motil:
Bakteri, yang tidak memiliki kemampuan intrinsik untuk bergerak di sekitar media, di mana ia tetap tersuspensi, adalah bakteri non-motil. Bakteri non-motil dapat menunjukkan motilitas yang nyata, akibat dari gerakan brownian mereka yang disebabkan oleh pemboman molekul air di media sekitarnya, pada sel bakteri.
Pada sediaan basah, meskipun bentuk dan ukuran bakteri dapat diamati, motilitas dapat terhambat, karena suspensi ditekan di antara kaca objek dan kaca penutup. Itulah mengapa; preparat tetes gantung atau uji motilitas dilakukan untuk pengamatan yang jelas terhadap motilitas bakteri, selain bentuk dan ukurannya. Berguna untuk identifikasi bakteri.
Prinsip:
Setetes suspensi bakteri yang sangat kecil digantungkan dari tengah slip penutup ke dalam rongga slide rongga. Tetesan gantung diamati di bawah mikroskop dengan menggunakan objektif oil immersion. Jika bakteri tersebut motil, sel-selnya dapat terlihat bergerak tidak menentu di media sekitarnya.
Sebaliknya, jika non-motil, sel-selnya tetap statis dalam medium tanpa gerakan apa pun atau mungkin menunjukkan gerakan kecoklatan akibat pemboman oleh molekul air dalam medium, pada sel bakteri.
Bahan yang Dibutuhkan:
Slide rongga, slip penutup, petroleum jelly atau Vaseline, minyak imersi, biakan bakteri kaldu 24 jam, loop dan mikroskop (senyawa, medan gelap atau kontras fase).
Prosedur:
- Slide rongga dibersihkan dengan benar di bawah air keran, sehingga air tidak tertinggal sebagai tetesan di permukaannya. Slide rongga adalah slide kaca dengan cekungan bulat kecil di tengahnya, di mana setetes kecil suspensi bakteri dapat digantung (Gambar 5.3).
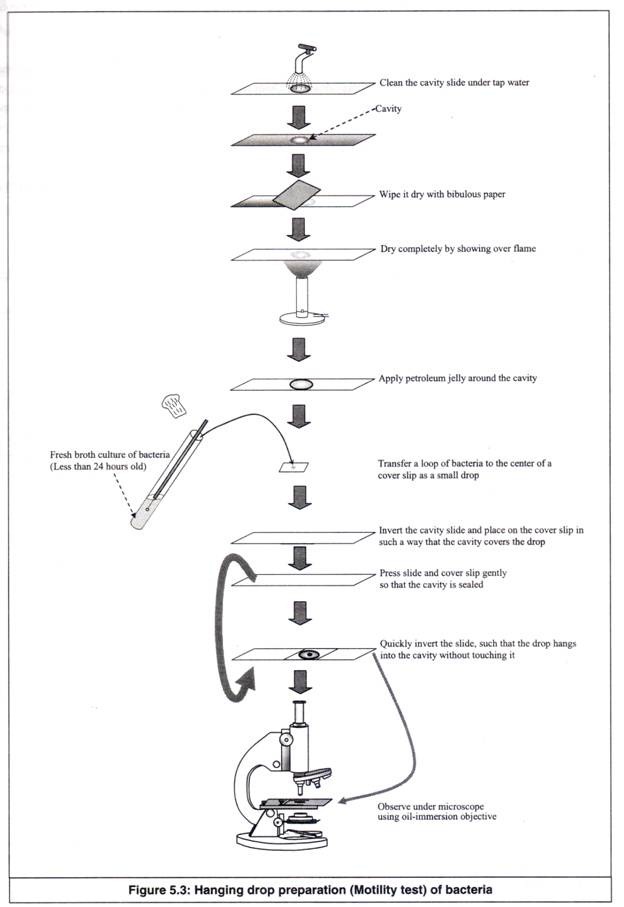
- Slide dikeringkan dengan menyeka dengan kertas bibulous dan selanjutnya, memindahkannya di atas api atau menjemurnya di bawah sinar matahari.
- Sebuah cincin dari petroleum jelly (atau vaseline) dioleskan di sekitar rongga.
- Sebuah loop disterilkan di atas api dan didinginkan. Sejumput suspensi bakteri diambil dari biakan kaldu yang berumur 24 jam secara aseptik. Setetes kecil suspensi ditempatkan di tengah slip penutup. Kultur kaldu tidak boleh lebih dari 24 jam, karena bakteri dapat kehilangan motilitasnya, seiring bertambahnya usia.
- Kavitas slide dibalik dan ditempatkan pada cover slip sedemikian rupa sehingga kavitas menutupi drop.
- Slide dan cover slip ditekan bersama dengan lembut, sehingga rongga tertutup rapat. Perawatan harus diambil untuk melihat bahwa tidak ada bagian dari rongga menyentuh drop.
- Slide dibalik dengan cepat, sehingga drop menggantung ke dalam rongga tanpa menyentuhnya.
- Slide dijepitkan ke panggung mikroskop.
- Ujung jatuhan difokuskan di bawah sasaran berdaya rendah.
Alasan untuk memfokuskan tepi penurunan adalah sebagai berikut:
(a) Kontras yang lebih baik diperoleh karena perbedaan indeks bias tetesan dan kaca penutup.
(b) Saat tetesan menggantung, ia menipis ke tepi, di mana tepi mengandung lebih sedikit bakteri untuk diamati dengan jelas motilitasnya.
(c) Biasanya bakteri aerob datang ke tepi untuk mendapatkan lebih banyak oksigen untuk respirasi, yang dapat diamati di tepi.
- Setetes minyak imersi diteteskan pada kaca penutup tepat di atas tetes gantung dan tepi tetes gantung diamati di bawah mikroskop objektif imersi minyak. Lebih disukai, mikroskop kontras fase atau medan gelap harus digunakan untuk pengamatan yang jelas.
Pengamatan (Under Oil-immersion Objective):
- Motilitas:
Motil atau non-motil
- Bentuk bakteri:
Bulat (coccus)
Berbentuk batang (basil)
Seperti koma (vibrio)
Spiral (spirocheta)
- Susunan bakteri:
Pasangan (diplobacillus/diplococcus)
Dalam empat (tetrad)
Berantai (streptococcus/streptobacillus)
Cluster seperti anggur (staphylococcus)
Kuboid (sarcinae atau oktet).
- Ukuran bakteri:
Dengan perkiraan mata, buatlah gambar bidang di bawah tujuan perendaman minyak.
(3) Pewarnaan:
Tujuan Pewarnaan:
Indeks bias sel bakteri sangat mirip dengan air, di mana mereka tersuspensi selama pengamatan dan juga dengan slide kaca, di mana mereka diamati di bawah mikroskop. Oleh karena itu, sangat sulit untuk mengamatinya dengan jelas.
Untuk mengatasi kesulitan ini, sel-sel diwarnai dengan noda, yang memberi warna yang dalam pada sel dan warna terang pada media sekitarnya, di mana mereka tersuspensi. Sel-sel berwarna gelap mendapatkan kontras yang jelas dengan latar belakang berwarna terang dan dapat diamati dengan jelas.
Jadi, pewarnaan adalah metode pemberian warna pada mikroorganisme transparan yang tidak berwarna dengan bantuan berbagai pewarna biologis yang disebut ‘noda’ untuk pengamatan mikroskopisnya.
Kimia Noda:
Zat pewarna terdiri dari tiga jenis sebagai berikut:
- Pewarna:
Mereka digunakan untuk pewarnaan tujuan umum seperti, untuk mewarnai bahan tekstil dan untuk mewarnai dinding.
- Noda:
Mereka digunakan untuk mewarnai spesimen biologis atau mikrobiologis. Ini lebih akurat dan teliti.
- Indikator:
Mereka adalah bahan kimia, yang berubah warna dengan perubahan konsentrasi ion hidrogen (pH).
Meskipun ‘noda’ adalah istilah yang tepat, istilah ‘pewarna’ digunakan secara luas dalam mikrobiologi yang berarti zat pewarna. Dahulu, pewarna alami dibuat dari berbagai tumbuhan. Mereka telah banyak digantikan oleh pewarna sintetis.
Karena pewarna sintetis pertama dibuat dari anilin, semua pewarna sintetis disebut ‘pewarna anilin’. Namun, sebagian besar pewarna ini sekarang diproduksi dari tar batubara yang sekarang disebut ‘pewarna tar batubara’. Pewarna tar batubara adalah turunan benzena. Molekul pewarna terdiri dari tiga komponen (Gambar 5.4) seperti yang diberikan di bawah ini.
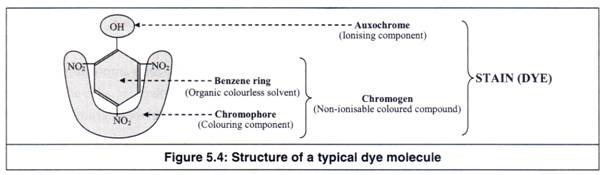
(a) Cincin benzena
(b) Gugus kromofor
(c) Gugus auxokrom
Benzene adalah pelarut organik tak berwarna, sedangkan kromofor adalah komponen pewarna pewarna. Benzena bergabung dengan kromofor untuk membentuk kromogen (Gambar 5.5). Karena kromogen tidak memiliki sifat untuk berdisosiasi, ia tidak dapat bergabung dengan sel dan mudah terhanyut.
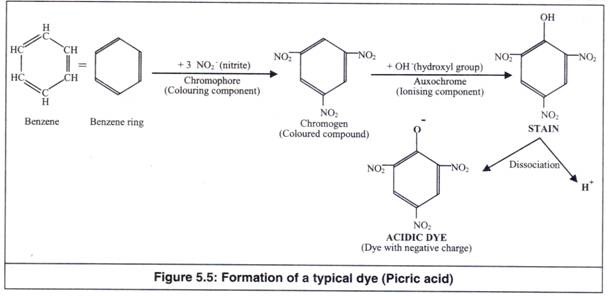
Ketika chromogen bergabung dengan auxochrome, pewarna atau noda terbentuk. Auxochrome menanamkan sifat disosiasi elektrolitik (sifat pembentuk garam) ke pewarna. Jadi, secara kimia noda didefinisikan sebagai senyawa organik yang mengandung cincin benzena, gugus kromofor, dan gugus aukokrom.
Jenis Pewarnaan:
Pewarnaan bakteri dari berbagai jenis seperti yang dijelaskan di bawah ini (Gambar 5.6).
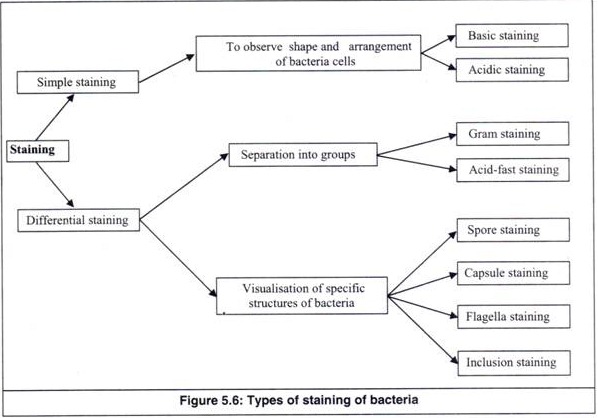
- Pewarnaan Sederhana:
Di sini, hanya satu noda yang digunakan. Pewarnaan ini digunakan untuk mengamati bentuk (cocci, bacilli, vibrio, spirilli) dan susunan (tunggal, berpasangan, tetrad, rantai, cluster) bakteri.
Ini terdiri dari dua jenis sebagai berikut:
- Pewarnaan Dasar:
Dalam pewarnaan dasar, pewarna dasar, seperti biru metilen, kristal ungu atau karbol fuchsin, digunakan untuk menodai sel bakteri. Noda mengikat erat sel bakteri dan memberikan warna noda yang dalam pada sel, sedangkan media di sekitarnya mendapatkan warna noda yang terang.
- Pewarnaan Asam:
Dalam pewarnaan asam, pewarnaan asam, seperti eosin atau nigrosin, digunakan untuk menodai sel bakteri secara negatif. Noda membuat sekitarnya berwarna, sedangkan sel bakteri tetap tidak berwarna.
- Pewarnaan Diferensial:
Di sini, lebih dari satu noda digunakan. Itu dilakukan untuk tujuan berikut.
- Pemisahan menjadi Grup:
Metode pewarnaan diferensial ini dilakukan untuk membedakan bakteri ke dalam kelompok yang berbeda berdasarkan karakteristik pewarnaannya.
Metode-metode ini termasuk yang berikut:
(sebuah) Pewarnaan Gram:
Metode pewarnaan ini dilakukan untuk membedakan antara bakteri gram positif dan gram negatif.
(b) Pewarnaan tahan asam:
Hal ini dilakukan untuk membedakan bakteri tahan asam dan tidak tahan asam.
- Visualisasi Struktur Spesifik Bakteri:
Metode pewarnaan diferensial ini dilakukan untuk memvisualisasikan komponen struktural spesifik sel bakteri.
Metode-metode ini termasuk yang berikut:
(sebuah) Pewarnaan Spora:
Metode pewarnaan ini digunakan untuk pewarnaan endospora bakteri pembentuk spora.
(b) Pewarnaan Kapsul:
Metode ini digunakan untuk menodai kapsul yang mengelilingi bakteri berkapsul.
(c) Pewarnaan Flagela:
Hal ini dilakukan untuk memvisualisasikan flagella dari bakteri flagellated.
(d) Pewarnaan Inklusi:
Metode pewarnaan ini dilakukan untuk menodai inklusi sel bakteri seperti butiran volutin, butiran glikogen dan butiran PBH.



